物化性質
物理性質
淡綠色斜方晶系,片狀結晶。熔點60.5℃。易溶於水。冷時呈濕狀態,穩定。化學性質
水溶液加熱變成鹼式硝酸鐵。硝酸亞鐵水溶液微弱水解
Fe(NO3)2+2H2O====Fe(OH)2+2HNO3
易被氧化
9Fe(NO3)2+6H2O====5Fe(NO3)3+3NO↑+4Fe(OH)3↓
溶液顯弱酸性
Fe2++2H2O====Fe(OH)2+2H+
在空氣中氧化
Fe(NO3)2→Fe(NO3)3
加熱可以分解Fe(NO3)2→FeO
水合物:Fe(NO3)2·6H2O
製備方法
由硝酸鐵溶液與銀進行還原反應製得。亦可用鐵屑在低溫溶解於密度1.05g/cm3以下稀硝酸,經冷卻結晶,離心分離製得。還可將硫酸亞鐵和硝酸鋇進行複分解反應製得。專利:將硫酸法生產鈦白粉所得廢酸與過量氫氧化亞鐵混合反應,生成硫酸亞鐵;過濾反應液,得到主要含硫酸亞鐵的濾液;向主要含硫酸亞鐵的濾液中加入過量的硝酸鋇反應,生成硝酸亞鐵和硫酸鋇,過濾反應液,分離硝酸亞鐵和硫酸鋇溶液;硫酸鋇沉澱經洗滌、乾燥和粉碎,得到硫酸鋇產品;硝酸亞鐵溶液中加入少量硫酸亞鐵中和硝酸鋇,而後送入鹼壓蒸餾器中減壓蒸餾為硝酸亞鐵過飽和溶液,冷卻結晶,乾燥,得到硝酸亞鐵產品。
特殊性質
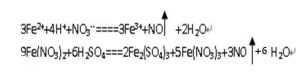 反應方程式
反應方程式硝酸亞鐵溶液中加入酸後可以發現溶液變黃,有無色氣體生成。因為3個亞鐵離子有較強的還原性,而硝酸根在沒有氫離子的條件下是不具有強氧化性的,後面加入酸帶入了氫離子,使得亞鐵離子和硝酸根氫離子發生了氧化還原反應。亞鐵離子被氧化成鐵離子。而硝酸被還原成一氧化氮。
4Fe2++NO3-+4H+=4Fe3++NO↑+2H2O
2、製備硝酸亞鐵時過量問題
稀硝酸過量Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
在酸性環境下,硝酸根(NO3-)有強氧化性,與二價鐵離子(Fe2+)發生氧化還原反應,生成鐵離子(Fe3+)和一氧化氮(NO)氣體。
鐵過量3Fe+8HNO3=3Fe(NO3)2+2NO+4H2O
鐵過量時,被氧化的鐵離子(Fe3+)與鐵屑(Fe)發生氧化還原反應,生成亞鐵離子(Fe2+)
3、保存方法
硝酸亞鐵溶液一般(實驗室)保存時裡面加進“碎鐵片”,從而保證了溶液保持中性(2Fe3++Fe=3Fe2+),且須用棕色瓶子包裝,否則日照會電離水,溶液中H+增加,導致亞鐵離子變成鐵離子。
主要用途
用作媒染劑、醫藥、分析試劑、催化劑等。用於製造九水硝酸鐵及其他鐵鹽。
常見謠言
謠言:氫氧化鈉與硝酸亞鐵反應生成氫氧化亞鐵和硝酸鈉。
駁斥:氫氧化亞鐵具有較強還原性,即使在鹼性條件下也可以還原硝酸根,硝酸亞鐵與鹼反應不需要氧氣參與,氫氧化亞鐵會在鹼性條件下被硝酸根氧化。

