組成結構
細胞膜
癌細胞的表面有一種腫瘤抗原(CEA),它能生成相應的抗體阻止癌細胞的生長和發展,這種自我免疫力是癌細胞與生俱來的又一矛盾。
細胞核
當代分子生物學的卓越成就,逆轉錄酶,這種逆轉錄酶的作用是使RNA再把自己所收到的DNA發來的變異電報返送回去,迫使DNA恢復正常的複製功能,這樣,癌細胞就變成了健康細胞。人體其實是由一個個細胞組成的社區。每個細胞照章行事,知道何時該生長分裂,也知道怎樣和別的細胞結合,形成組織和器官。而構建不同組織的“圖紙”,就是基因。
現代遺傳學研究表明,人人體內都有原癌基因和抑癌基因,絕對不是人人體內都有癌細胞。原癌基因主管細胞分裂、增殖的周期,人的生長需要它。同時人體裡還有抑癌基因,它可以抑制細胞的不正常增殖。平時,原癌基因和抑癌基因發揮著正常的作用,它們是細胞內正常的基因,但在致癌因素作用下,原癌基因和抑癌基因一旦發生基因突變,將無法正常調節細胞的分裂、增殖,細胞可以無限增殖傳代,也就是細胞發生了癌變。因此,致癌因素是啟動癌細胞生長的“鑰匙”,主要包括精神因素、遺傳因素、生活方式、某些化學物質等。致癌因素易誘發基因突變,多把“鑰匙”一起用,才能啟動“癌症程式”;“鑰匙”越多,啟動機會越大。也就是說,癌症是基因突變累積的結果,單個細胞的癌變並不能導致癌症,它可以被人體免疫系統識別並清理。我們還無法破解所有“鑰匙”,也難以高效地清除全部癌細胞,因此還無法全面地攻克癌症。
病理分析
正常的細胞由於物理、化學、病毒等 致癌因子導致的 原癌基因和抑癌基因突變而轉變為癌細胞 。
 顯微鏡下的癌細胞
顯微鏡下的癌細胞自行設定增殖速度,累積到10億個以上我們才會察覺。癌細胞的增殖速度用倍增時間計算,1個變2個,3個變6個,以此類推。比如,胃癌、腸癌、肝癌、胰腺癌、食道癌的倍增時間平均是31天;乳腺癌倍增時間是40多天。由於癌細胞不斷倍增,癌症越往晚期發展得越快。
癌細胞的內外潛藏著自身無法克服和無法排除的逆轉因素,這是它的特點,也是它的缺點,造就了它的不穩定性。
科學家指出,癌症細胞在轉移過程中會遇到很多困難,首先要經過數十次變異,然後要克服細胞間粘附作用脫離出來,並改變形狀穿過緻密的結締組織。成功逃逸後,癌症細胞將通過微血管進入血液,在那裡它還可能遭到白細胞的攻擊。接下來癌細胞將通過微血管進入一個新器官(現被稱為“微轉移”)。在這裡,癌細胞面臨著並不友好的環境(稱作“微環境”),有些細胞當即死亡,有些分裂數次後死亡,還有一些保持休眠狀態,存活率僅為數億分之一。存活下來的癌細胞能夠再生和定植,成為化驗中可發現的“肉眼可見轉移”。隨著轉移的發展,它擠走了正常的細胞,破壞了器官的功能,最後足以致命。
主要特徵
 癌細胞
癌細胞癌細胞是由正常細胞轉化而來,它除了仍具有來源細胞的某些特性(如上皮癌仍可合成角質蛋白)外,還表現出癌細胞獨具的特性。
⑴無限增殖
在適宜條件下,癌細胞能無限增殖,成為“不死”的永生細胞。正常細胞都具有一定的最高分裂次數,如人的細胞一生只能分裂50~60次。然而癌細胞卻失去了最高分裂次數。如在1951年由一位黑人婦女(名叫Henrietta Lacks)的宮頸癌細胞分離建立的HeLa細胞系,至今仍在世界許多實驗室中廣泛傳代使用。
⑵接觸抑制現象喪失
正常細胞生長相互接觸後,其運動和分裂活動都要停頓下來。在體外培養條件下則表現為細胞貼壁生長匯合成單層後即停止生長。癌細胞則不同,其分裂和增殖並不因細胞相互接觸而終止,在體外培養時細胞可堆累成立體細胞群,故癌細胞接觸對癌細胞的增殖無抑制作用。
⑶癌細胞間粘著性減弱
癌細胞與其同源正常組織相比,細胞間的粘著性降低,故癌細胞在體內容易分散和轉移。在正常細胞外被中的纖粘連蛋白是一種細胞外粘著糖蛋白,它增強了細胞與細胞外基質間的粘著。癌細胞的纖連粘蛋白顯著減少或缺失,鈣粘蛋白合成發生障礙,從而破壞了細胞與基質之間和細胞與細胞之間的粘著,因此癌細胞具有易於侵潤組織和轉移的屬性。
⑷易於被凝集素凝集
 癌細胞繁殖
癌細胞繁殖與正常細胞相比,癌細胞更容易被凝集素所凝集,故引起癌細胞凝集所需的凝集素濃度要比正常細胞的低得多。癌細胞凝集性增強是由於質膜結構發生深刻變化所致。糖蛋白在質膜中的運動性增強,因而凝集素更容易將其受體(糖蛋白)簇集,形成更多的橫橋。質膜糖蛋白運動性增強還可能是由於與其相連的微絲受到破壞所致。
⑸粘壁性下降
在體外培養中,細胞貼壁生長,這與細胞分泌葡糖胺聚糖粘性物質有關。葡糖胺聚糖是構成細胞外基質的主要成分,可形成水合凝膠。癌細胞合成葡糖胺聚糖減少,導致細胞粘壁性能下降。
⑹細胞骨架結構紊亂
癌細胞中微管變短,排列紊亂,微絲亦發生結構異常。src基因(即誘發肉瘤的基因)的產物PP60src是一種蛋白質激酶,該酶可使張力纖維兩端的粘著斑蛋白磷酸化,而使張力纖維與質膜脫離。肌動蛋白絲的量減少,引起質膜流動性增強,細胞屬性發生改變。由於細胞骨架結構紊亂,導致細胞外形亦發生改變。例如培養中的正常成纖維細胞呈扁平梭形,但被鳥類肉瘤病毒(含src癌基因)轉化後,則變成球形,表面出現小泡,此即由於細胞骨架成分紊亂所致。
⑺產生新的膜抗原
癌細胞丟失了質膜上的主要組織相容性抗原,而出現了一些新的相關性膜抗原。這些新的膜抗原是由正常細胞表面的糖蛋白修飾而成。同時由於表面蛋白質運動增強,使表面蛋白更易被相應抗體所凝集。
⑻對生長因子需要量降低
正常細胞在體外一般要在含有10%以上的血清的培養液中才能生長,血清中含有一些細胞生長所需要的生長因子,如表皮生長因子(EGF)、血小板衍生生長因子(PGDF)、胰島素等。而轉化細胞卻能在血清濃度很低的培養液中生長,對生長因子的需求量大大降低。
此外,癌細胞還有許多不同於正常細胞的屬性,如葡萄糖運輸增加,產生新的細胞分泌物,還有具有豐富的內質網和高爾基體等。
單個癌細胞的形態特點
 癌細胞
癌細胞主要表現在細胞核上,可歸納為五大特徵:
⑴核大:癌細胞核可比正常大1-5倍。 但核膜不內折。
⑵核大小不等:由於各個癌細胞核增大程度不一致,同一視野的癌細胞核,大小相差懸殊。
⑶核畸形核膜增厚:癌細胞核可出現明顯的畸形,表現為細胞核形態不規則,呈結節狀、分葉狀等,核膜出現凹陷、皺褶,使核膜呈鋸齒狀。
⑷核深染:由於癌細胞核染色質增多,顆粒變粗,核深染,有的可呈墨水滴樣,同時因核內染色質分布不均,核的染色深淺不一。
⑸核質比例失常:超過細胞體積的增大,癌細胞核增大明顯,故核質比例失常。並且癌細胞分化愈差,核質比例失常愈明顯。此外,細胞核染色質邊移,出現巨大核仁,異常核分裂,以及細胞體積增大,且大小不等,並出現梭形、蝌蚪形、星形等異常形態,亦可作為癌細胞的輔助診斷依據。
此外還有
⑹癌細胞具有豐富的游離核糖體。
⑺癌細胞的表面發生了變化,由於細胞膜上的糖蛋白等物質減少,使得細胞彼此之間黏著性顯著降低,容易在體內分散和轉移
2.成堆癌細胞的排列特點
成片鱗癌細胞,仍可帶有一定程度的鱗狀上皮的排列特點,如平鋪的鵝卵石樣,但極性消失,排列不規則;腺癌可出現不規則的腺腔樣排列;未分化癌則表現為束狀(單行)排列及鑲嵌樣(成片)排列等特徵,這些可作為診斷癌細胞和進行癌細胞分類的依據。
(二)塗片的“陽性背景”
由於腫瘤組織,特別是浸潤癌和分化差的癌,易發生出血壞死。因此,塗片中常常可見成片的紅細胞和壞死細胞碎片,這種背景往往提示塗片可能為陽性,所以稱陽性背景。早期癌塗片背景多數乾淨,不易見到壞死細胞碎片。出血壞死並非腫瘤所獨有,在某些嚴重的炎症病變中也可出現,所以在沒找到癌細胞之前,決不能單憑陽性背景的有無,而診斷癌或排除癌。
主要種類
 癌細胞
癌細胞癌細胞大致可分為三大類:鱗癌、腺癌、未分化癌。
1.鱗癌
一般起源於鱗狀上皮,也可起源於已經發生鱗化的柱狀上皮。根據圖片中大多數癌細胞的分化程度,可把鱗癌分為分化好和分化差兩大類。
高分化(角化型)鱗癌 以類似表層細胞的癌細胞為主,並可見少量中層癌細胞,這些癌細胞分化比較成熟,表現多形性,如纖維形、蝌蚪形、蛇形等癌細胞,常散在分布。癌細胞胞質角化明顯,故稱角化型鱗癌。
低分化(非角化型)鱗癌 癌細胞形態類似底層鱗狀上皮細胞,少數類似中層鱗狀上皮細胞,不出現或很少出現表層癌細胞。癌細胞形態主要為圓形、卵圓形,多數成片脫落,也可單個散在,胞質少、不角化。HE染色呈暗紅色,巴氏染色為暗綠色,核大,核仁清楚。
2.腺癌
一般起源於柱狀上皮和腺上皮。根據癌細胞大小,細胞內的粘液多少,有無形成腺腔樣結構,腺癌亦可分為兩型。
高分化腺癌 常形成腺樣排列。癌細胞大,胞質豐富,HE染色為淺紅色,巴氏染色為淺綠色,其中可見粘液空泡。核大,核染色質顆粒粗,染色深,核仁巨大。
低分化腺癌癌細胞小、胞質少,嗜鹼性,粘液空泡少見。癌細胞常成團脫落,排列緊密,形成桑椹樣結構。核小偏位,邊緣胞質隆起。核染色質較粗,核仁小。
3.小細胞型未分化癌
一般認為起源於支氣管上皮的嗜銀細胞,可產生多肽類激素而引起內分泌症狀,故屬於神經內分泌腫瘤。癌細胞小,圓形、卵圓形或瓜子形。胞質極少,細胞核約比淋巴細胞大半倍到一倍,核畸形明顯,染色深,癌細胞排列緊密而不重疊,成片出現時,往往呈鑲嵌樣結構;單行排列時呈束狀。這是未分化癌的特徵性表現。
形成因素
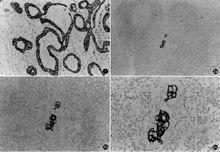 癌細胞
癌細胞癌細胞研究已成為生物醫學上探索癌變機理的腫瘤生成規律的一個活躍領域。對癌細胞產生的原因,還沒有一致的見解。一些人認為正常細胞轉化為癌細胞是由於致癌病毒誘發的。大多數人同意勃伏利1914年提出的許多癌症的起因是體細胞突變的理論。支持這一觀點的論據之一是癌症的發病率隨年齡而增長,論據之二是已知能誘發基因突變的所有化學誘變劑或物理因素,幾乎都是致癌的,如瀝青中的一些化學物質經常接觸皮膚,能引起皮膚癌;大劑量苯中毒時,能誘發白血病(血癌);吸菸引起肺癌,這和菸葉中的尼古丁有關;經常接觸放射性物質或從事放射線工作的人,白血病、骨髓癌的發病率較高。因此,加強環境保護,消除環境污染,及時檢查可疑的致癌物質,並加以防除,對放射性工作加強安全保護等,都可以降低癌症發病率。
內部成因
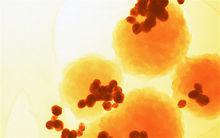 癌細胞
癌細胞在正常情況下,細胞記憶體在著與癌症有關的基因,這些基因的正常表達是個體發育、細胞增殖、組織再生等生命活動不可缺少的,這些基因只有發生突變時才有致癌作用,變成癌基因。這些具有引起細胞癌變潛能的基因稱為原癌基因(proto-oncogenes)。原癌基因屬於顯性基因,等位基因中的一個發生突變,就會引起細胞癌變。正常細胞中雖然存在著原癌基因,但是原癌基因的活動受到嚴格的精密調控,其編碼產物是細胞生長和分化所必需的,不會引起癌變。然而,當原癌基因發生了變化,產生了超出細胞活動所需要的產物,就會引起細胞癌變。原癌基因的這種變化稱為原癌基因的激活。
癌症起始於一個細胞突變,而人體是由大量體細胞組成的。人的一生大約要進行10^16次細胞分裂。即使不接觸致癌劑,每個基因發生自然突變的機率為10-6。可以推算出人的一生中每個基因會有10^10突變機率。由此估計,一個突變細胞中應當有許多與細胞增殖有關的基因發生突變,失去了對細胞增殖的調控能力。然而事實上,人體癌症發病率並沒有預想的那樣高。由此可見,一次突變並不足以將一個健康細胞轉變為癌細胞。一個細胞癌變要求在一個細胞中發生幾次單獨的突變,它們共同作用才能誘發細胞癌變。經統計,一個細胞轉化需要發生3~7次單獨的隨機突變。
雖然癌症起始於一個細胞突變,但是這個突變細胞的後代必須經過幾次突變,才能形成癌細胞。流行病學的統計表明,癌症的發病率隨年齡的增長而提高,而且是幾何級數提高,癌症的發病率是年齡的3次方、4次方甚至5次方。癌症的漸進發生過程非一日之寒,需要數年時間,在此期間既有內因的作用,也有外因的誘發,致癌因子需要有劑量累積效應。癌症的發生要有許多因子的共同作用。體內還有免疫監控系統,可以隨時消滅癌細胞。因此,許多癌症不是不可避免的。
細胞中還存在另一類基因與遏制細胞增殖有關,這類基因的缺失或失活,也可引起細胞癌變,這類基因叫做抑癌基因(antioncogenes)或腫瘤抑制基因(tumorsuppressorgenes)。抑癌基因與原癌基因不同,抑癌基因是隱性基因,需要兩個等位基因都突變失活,才能引起細胞癌變。如果親代傳遞給後代的某一抑癌基因中有一個等位基因無功能,這個後代個體就容易患癌症。在正常細胞中,原癌基因與抑癌基因協調配合,共同維持細胞的正常增殖活動。
化學致癌
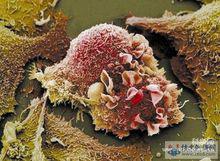 癌細胞
癌細胞這類因素是導致腫瘤的主要原因,其來源甚廣,種類繁多。經考察和動物實驗證實有致癌作用的化學物質已發現有千餘種,其中與人類關係密切的化學致癌物就有數百種之多。化學物質致癌潛伏期的相對較長,對人類危害極大,它廣泛存在於食物、生產作業環境、農藥、醫療藥品之中。人們所熟知的黃麴黴毒素(也稱黃麴黴素),在花生、玉米、高粱、大米等許多糧食作物中都有沾染,它具有公認的致癌作用,有明顯的致癌力,已被證實可導致肝癌的發生。廣布於自然界的亞硝胺類化合物(在醃製過的魚、肉、雞中含量較高)和燻烤或燒焦後的食物中(尤其是高蛋白食品,如魚、肉、蛋類)致癌物的種類和含量劇增,以及受到多環芳烴類化合物,如3,4苯並芘、二甲基苯蒽、二苯蒽等致癌物污染的空氣,以及二惡英污染均會對人體產生影響,嚴重的會誘發並導致肺癌、鼻咽癌、食管癌、賁門癌、胃癌、肝癌、白血病、膀胱癌、大腸癌、陰囊癌、皮膚癌等。
物理致癌
物理致癌因素包括灼熱、機械性刺激、創傷、紫外線、放射線等。值得高度重視的是,受輻射危害可以來自環境污染,也可以來自醫源性。比如多次反覆接受X射線照射檢查或放射性核素檢查可使受檢人群患腫瘤機率增加,若用放射療法治療某些疾病,也可誘發某些腫瘤。有資料報告,在用放射性核素磷治療紅細胞增多症後,相當數量的患者經過一定的潛伏期而出現白血病。肺結核患者反覆的胸透檢查,可誘髮乳腺癌。
生物致癌
對這類因素研究較多的是病毒。近代科學研究已證明,有30多種動物的腫瘤是由病毒引起的。發現人類的某些腫瘤與病毒的關係密切,在一些鼻咽癌、宮頸癌、肝癌、白血病等患者的血清中可以發現有相應病毒的抗體。有資料報導,血吸蟲病可誘發大腸癌、肝癌等。
綜上也可以說是癌細胞是因為致癌因子激活了原癌基因。
研究原理
一、細胞學原理
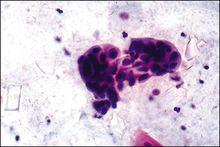 癌細胞
癌細胞癌細胞的內外潛藏著自身無法克服和排除的逆轉因素,這是它的特點,也是它的缺點,造就了它的不穩定性。
一在細胞膜上
癌細胞的生存和發展離不開蛋白質的合成,然而,癌細胞在合成蛋白質時,則必須從健康細胞中奪取門冬醯胺,可是,與門冬醯胺共生的門冬醯胺酶卻能控制癌細胞的生長,這是它無法克服的第一個矛盾。
在大量的科學驗證明,人體內每個細胞的細胞膜上存在著一種C-Amp(環式磷酸腺苷)的物質,這種物質是控制或調整細胞新陳代謝的主要成份(並不因為癌化而消失),最有趣的是C-Amp還有一個最顯著的能力,就是使癌細胞變成健康細胞(這是難能可貴的)。
癌細胞的表面有一種腫瘤抗原(CEA),它能觸發免疫系統生成相應的抗體阻止癌細胞的生長和發展,這種自我免力是癌細胞與生俱來的又一矛盾。
二在細胞質中
美國科學家謝伊1994年12月發現癌細胞中有一種能使癌細胞不斷複製並保持其遺傳特性的酶(Telomerase)。此酶的活性若被抑制和破壞,癌細胞的複製工程,也只好終止和結束。
二、生物學原理
癌細胞與胚胎細胞類似(形態、功能、代謝),具有鮮明的生物學行為,癌細胞是細胞在惡劣的環境中生成的,特別具有反抗性。由於細胞癌化之後,反饋控制減弱或消失,它變得無正常規律,一旦遇到不利的條件(刺激、中傷)它就能轉移,甚至隱匿起來(癌的癌細胞就有這種不吃不動的休眠、假死本領,由分裂增殖期迅速進入GO期,任何藥物都對它沒有什麼療效),癌細胞怕熱(熱敷有利於消散),癌細胞代謝力強,吸收多,排泄的也多,對機體破壞性很大。
針對癌細胞的這些習性和特點,若能因勢利導,予以滿足,由可隨機而安。這就為藥物的選用提供了特定性的先決條件,投其所好,大補氣血,不僅可以減輕它對機體的傷害和破壞,並增強機體的內在抗力,還可以調動和增強癌細胞細胞自身逆轉因素的活性,使之變為健康細胞。
三、生化學原理
中國國家級有突出貢獻的癌症研究家戴乾環在他的致癌“雙區理論”和“轉錄基因”研究成果中,也進一步證實了“致癌作用的關鍵步驟是互補鹼對之間的交連”(《人民日報》1993年8月15日)、“致癌的機理則是互補移碼變異”並且,戴乾環還通過大量的量子化學計算法,發現“化合物在體內發生致癌作用的必要條件是它在體內新陳代謝過程中能產生兩個活潑的烷化反應中心,這兩個中心間有利於致癌潛力發揮的最優距離為2.8-3.0埃米(1/ 10000000000米),這個距離正好與體內細胞的脫氧核糖核酸(DNA)股間互補鹼對負性原之間的距離相吻合”。我認為,既然“互補移碼變異”可以使DNA的結構發生變化,使癌細胞化,同理,如果我們所施用的進入人體的化合物不是“容易癌化”(其烷化反應中心間距在2.8-3.0埃米)的亞硝酸鹽或3-4苯並芘之類,而是兩個烷化中心間距大於或小於2.8-3.0埃米的且能更活潑的與之化合而使之游離出來的阿斯匹林氯奎林、奎林之類,那些么,DNA就還原了,癌細胞就又變成了健康細胞。
尤其值得重視的是,促使細胞癌化的物質(DNA互補鹼對負性原子上的結合物)並不穩定,很容易與烷化中心間距不相同(大於或小於2.8-3.0埃米之間的物質組成新的物質集團,而游離出細胞之外。這就是說,烷化中心間距在2.8-3.0埃米之間的物質可以致癌,而化學活動性強的烷化中心距大於或小於2.8-3.0埃米之間的化合物卻又能治癌而使癌細胞轉化,這是戴氏“雙區理論”的演繹,決不是憑空的假設和虛幻的臆斷,這是戴氏對人類的特大貢獻。
四、生理學原理
人體免疫系統在保衛機體和排除異已、維持靜態平衡方面,不僅活潑而積極,並且具有強大的威力。這種免疫機制,不光不給癌細胞提供合適的生存與發展條件,反而能促使癌細胞的自峰逆轉因素相對強化、間接地使之逆轉,同時,還會直接地干擾、阻止癌細胞的複製,甚至殺死癌細胞,因此,使用藥物調動人體的內在抗力是治癌工程中的核心和關鍵。
調動人體各大臟器的統一制癌能力,全方位地增強細胞免疫、體液免疫、組織免疫,在促進癌細胞逆轉的治癌過程中,也有十分重要的意義。
達爾文的器官相關定律表明,一個器官受損,就會影響多個器官受牽連。機體是一個統一的有機整體,在治癌過程中不能忽略這一點。
五、設計學原理
細胞癌化之後,內外各種逆轉因素的活性都相對地減弱或下降,可謝伊癌復酶的活性反而增強,保證DNA瘋狂複製而不改變其遺傳特性,在這種情況下,我們若能協助機體,施用具有針對性的藥物,降低或消除謝伊癌復酶的活性、加強C-Amp和逆轉錄酶的逆轉活力,則癌細胞就不得不轉化為健康細胞了。這就是說,內因和外因的結合,主觀能動性和客觀條件的結合,在推進和加速癌細胞的逆轉工程中具有特殊的價值(轉化得轉化,不轉化也得轉化)。
轉移原因
癌細胞常很不安分,迅速擴散轉移到其它臟器中去,這一秉性與癌的生長方式及癌細胞的特性有關,其原因可歸納為以下幾個方面:
一、癌細胞繁殖速度快,由於數量急劇地增加,原有的空間容納不下那么多細胞,腫瘤邊緣的細胞就被"擠"進周圍的組織。
二、由於癌細胞表面的化學組成及結構的特殊性,使癌細胞間的粘著力低,連線鬆散,容易與癌塊脫離,為擴散創造了條件。
三、癌細胞分泌特殊物質,溶解及破壞周圍組織,為擴散轉移開闢了道路。
四、癌細胞含有一種能促使血栓形成的特殊物質,使癌細胞進入血管後得以附著在血管壁或其它部位並繼續生長,為血行轉移奠定基礎。
演化方式
轉移
癌細胞的轉移可能是因為喚醒了身體中沉睡的胚胎髮育相關轉錄因子所致。
一般來說,癌細胞進行轉移會分為幾個階段:
第一個階段稱為侵犯(invasion),這個階段中癌上皮細胞會鬆開癌細胞之間的連線,使得癌細胞“重獲自由”而能移動到其他地方去。
第二個階段稱為內滲(intravasation),癌細胞穿過血管或淋巴管的內皮進入循環系統。
第三階段稱為外滲(extravasation),在這個階段當中,經過循環系統之旅洗禮的倖存者,會穿過微血管的內皮細胞到達其他的組織。
最後的階段就是這些癌細胞的新大陸移民,在其他組織當中繁衍茁壯形成轉移的惡性腫瘤。
常見的癌細胞轉移有以下幾個:
淋巴道轉移-常見於各種癌,侵入淋巴管的癌細胞隨淋巴首先到達局部淋巴結,繼續發展可轉移到鄰近或遠處淋巴結。如乳腺癌首先轉移到同側腋窩淋巴結,之後可轉移到鎖骨下和鎖骨上淋巴結,甚至對側腋窩淋巴結。
血道轉移-常見於各種肉瘤、內分泌癌和未分化癌,直接侵入血管或經淋巴管再入血管的瘤細胞隨血流到達其他部位。最常見的轉移部位是肺、腦、肝和骨。胃腸道癌常轉移至肝和肺,乳腺癌、腎癌、骨肉瘤等常轉移到肺,肺癌易轉移至腦,前列腺癌易轉移至骨。
種植轉移-從腫瘤表面脫落的瘤細胞在胸腔、腹腔和腦脊髓腔等處發生的種植性生長,由於重力的緣故,往往種植在這些空腔的下部,如肋膈角、直腸膀胱窩、顱底等處。
自爆
瑞典卡羅林斯卡醫學院的科學家發現一種化合物能使最具威脅的腦腫瘤——膠質母細胞瘤的細胞發生“自爆”,並通過小鼠實驗進行了證實。該發現被認為開啟了一種全新的癌症治療機制,為其他類型癌症的治療提供了思路。相關研究成果發表在《細胞》雜誌上。
膠質母細胞瘤是一種腦部惡性腫瘤,因其生長速度快,病程一般較短。患者平均生存期只有15個月,以手術、放療和化療為主,但療效並不理想,因此,急需找到更好的治療方法。
據物理學家組織網報導,為達到這一目的,卡羅林斯卡醫學院的研究人員將膠質母細胞瘤細胞暴露在200多種分子中進行測試。經過仔細的篩選和實驗,最終發現了這種名為Vacquinol-1的化合物。
研究人員發現,這種化合物能導致癌細胞出現不受控制的空泡化:癌細胞會將外部物質源源不斷地帶入細胞內部,並最終導致細胞膜的破裂和癌細胞的壞死。進一步的研究發現,這個運輸過程通過細胞內的囊泡系統來完成,與2013年諾貝爾生理學或醫學獎成果很相似。三位科學家因發現細胞內的主要運輸系統——囊泡運輸的調節機制而獲得此獎。
擴散
 殺死癌細胞的食物
殺死癌細胞的食物癌是"橫行無法的",常很不安分,迅速擴散轉移到其它臟器中去,一秉性與癌的生長方式及癌細胞的特性有關。其原因可歸納為以下幾方面:
一是癌細胞繁殖速度快,由於數量急劇地增加,原有的空間容納不下那么多細胞,腫瘤邊緣的細胞就被"擠"進周圍的組織。
二是由於癌細胞表面的化學組成及結構的特殊性,使癌細胞間的粘著力低,連線鬆散,容易與癌塊脫離,為擴散創造了條件。
三是癌細胞分泌特殊物質,溶解及破壞周圍組織,為擴散轉移開闢了道路。
四是癌細胞含有能促使血栓形成的特殊物質,使癌細胞進入血管後得以附著在血管壁或其它部位並繼續生長,為血行轉移奠定基礎。
治療方法
手術
是最早套用的治療癌症的方法,也是許多早期癌症治療的首選療法。許多早期癌症可以通過成功的手術達到根治的目的。一些癌症病人病情發展到晚期,無法進行根治性手術,但是為了減輕病人痛苦,延長病人生命,也可進行手術,這種手術稱為姑息性手術。例如結腸癌阻塞腸腔,無法正常排便,則要採取大腸造瘺的姑息性手術以解除腫瘤對腸腔的阻塞。不是任何癌症都可以進行手術的,例如血癌(即白血病)就無法手術切除。
術後護理
癌病人在化療期間以及術後的護理對病人的康復起著至關重要的作用,應著重注意以下事項:
⑴供給易消化吸收的蛋白質食物,如牛奶、雞蛋、魚類、豆製品等,可提高機體抗癌力。其中牛奶和雞蛋可改善放療後蛋白質紊亂。
⑵進食適量糖類,補充熱量。大劑量放射治療病人,可使其體內的糖代謝遭到破壞,糖原急劇下降,血液中乳酸增多,不能再利用;而且胰島素功能不足加重。所以補充葡萄糖的效果較好,另外宜多吃蜂蜜、米、面、馬鈴薯等含糖豐富的食物以補充熱量。
⑷放療和化療的病人,一般宜進食涼食、冷飲,但有寒感的病人,則宜進食熱性食物。
⑹飲食多樣化,注意色、香、味形,促進病人食慾;烹調食物多採用蒸、煮、燉的方法,忌食難消化的食品,禁飲酒。
⑺維生素A和C有阻止細胞惡變和擴散,增加上皮細胞穩定性的作用,維生素C還可防止放射損傷的一般症狀,並可使白細胞水平上升;維生素E能促進細胞分裂,延遲細胞衰老;維生素B1可促進病人食慾,減輕放射治療引起的症狀。因此,應多吃含上述維生素豐富的食物,如新鮮蔬菜、水果、芝麻油、穀類、豆類以及動物內臟等。
藥品
即用化學藥物治療癌症,一般都是指西藥抗癌藥。這些藥物能在癌細胞生長繁殖的不同環節抑制或殺死癌細胞,達到治療目的。但現有的化學藥物在殺傷癌細胞的同時對正常人體細胞也有損害。因此,進行化療時往往出現不同程度的副作用,如噁心、嘔吐、脫髮等。化療主要用於各種類型的白血病以及用於無法手術而又對放療不敏感的病人。此外,也用作癌症手術後的輔助療法,以便殺死散在的或只能在顯微鏡下才能發現的癌細胞,推遲或預防癌症復發。
放射
普通放射
是用放射線殺死癌細胞以達到治療目的。有些癌症對放療效果好,或稱對放療敏感,例如霍奇金病、非霍奇金淋巴瘤、白血病等;而另一些癌症則對放療不敏感,即效果不好,例如胰腺癌、結腸腺瘤、軟骨肉瘤及黑色素瘤等。放療可以有效地殺死癌細胞,可以避免手術造成的組織缺損和畸形。當癌已向周圍組織蔓延或轉移到別處,手術無法徹底切除,就可以用放療來殺死癌細胞。與化療一樣,普通放療也對人體正常細胞造成損傷,所以會產生一系列副作用。
立體定向放射
無創性立體定向放射是世界醫學界治療腫瘤的領先技術,具有療效好、準確、安全、無創傷、將患者痛苦減低至最小程度的特點。立體定向放射療法的精確度非常高。人工手術輕微的抖動範圍就可達到3-4毫米,高於立體定向放射誤差的10倍以上;普通放療通過單一平面來治療腫瘤,放射線劑量達到腫瘤致死量時,勢必嚴重損傷包圍腫瘤的正常組織;立體定向放射是將所有放射線集中在腫瘤組織上進行精確治療,對正常組織的損傷極其微小。另外,立體定向放療可以避免種植性轉移和血液轉移。人工手術在腫瘤切割及拿出過程中,很難保證腫瘤組織細胞完全不脫落,容易把腫瘤種植在正常組織上而形成新的腫瘤。這就是醫學上常見的種植性轉移;另外腫瘤組織細胞也有可能在手術中通過血液轉移。立體定向放療則可避免這樣的轉移,同時避免手術引起的感染和併發症,以及因開刀給患者帶來的痛苦和風險。
補硒
1973年,世界衛生組織宣布:硒是人體必需的微量元素之一,硒與癌症的發生密切相關。1986年,中國醫學科學院的專家在我國江蘇省啟東市肝癌高發區進行了3項營養性補硒研究。經過8年觀察,發現服硒組的肝癌發生率較對照組平均低49%。
硒在代謝過程中穩定地產生甲基化代謝物,其抑癌作用是通過以下途徑實現的:
一、抑制癌基因的表達,通過增強谷胱甘肽過氧化酶活性消除體內自由基,保護細胞膜結構,防止基因突變;
二、有效增強人體免疫功能;
三、增強癌細胞中CAMP的水平,使DNA、RNA蛋白質的合成受到抑制,抑制癌細胞的分裂與增殖;
四、通過抑制葡萄糖有氧酵解,阻斷癌細胞的能量供應,促使癌細胞凋亡;
五、使腫瘤內未成熟的新生血管基底膜保持完整,減少腫瘤細胞進入血循環發生遠處轉移的機會。
我們應該如何補充這種微量元素呢?硒分為有機硒和無機硒,無機硒主要是亞硒酸鈉,過量服用會產生不良反應。有機硒是最好的硒源,富含硒的食物有100微克植物活性硒(富硒玉米粉)、小麥胚芽、大蒜、蘆筍、芝麻、菌類等,還有許多海產品。最新的研究成果表明,通過天然植物轉化技術獲得的植物活性硒最為安全有效,這種有機硒幾乎不與其他藥物產生拮抗作用,利於人體吸收。
免疫
患癌症的病人,體內免疫功能往往低下才造成了癌症發生、發展以至擴散。
免疫療法的目的就是通過各種手段來提高機體免疫功能,從而達到遏制癌的生長或擴散的目的。提高免疫力的製劑稱為免疫增強劑,其中有我們熟悉的卡介苗,還有轉移因子、干擾素、免疫核糖核酸等。免疫療法副作用小,但難以達到根治癌症的目的。因此,通常用它作為手術後和化療、放療的輔助治療,以達到鞏固療效及防止復發的目的。
內分泌
適用於那些發生、發展及治療與體內激素含量密切相關的症,即激素依賴性癌症。這些癌症主要有乳腺癌、前列腺癌、子宮內膜癌及甲狀腺癌。其原理是通過服用或注射某種激素對體內激素水平進行調整,達到控制癌生長的目的。例如用雄激素治療乳腺癌、雌激素治療前列腺癌、甲狀腺素片治療甲狀腺癌等等。內分泌療法仍然作為癌症的輔助治療手段,不能取代手術、放療和化療。
導向
是一種比較新的治療癌症的技術。它與一般化療不同之處是將殺死癌細胞的化療藥物與一種專門與癌細胞結合的物質結合在一起。用藥後,藥物絕大部分集中在癌細胞上,化療藥物可以最大限度地殺死癌細胞,對正常細胞影響小,因此療效高,副作用小。已研製出多種針對不同癌症的單克隆抗體它像雷射制導的飛彈一樣精確地“飛向”癌細胞,攜帶的彈頭就是殺傷癌細胞的藥物。
冷凍加溫
低溫(-40℃以下)和高溫(45℃以上)都可以將癌細胞殺死。因此人們開展了用液氮冷凍治療淺表皮膚癌和某些良性皮膚腫瘤,以及局部加溫治療皮膚癌、四肢癌和膀胱癌。加溫方法有短波、超短波、微波及雷射等手段。
基因療法
基因是細胞內的遺傳物質,化學成分是脫氧核糖核酸(DNA)。不同的基因起著不同的生物學作用,而癌症的發生、發展均與細胞內基因發生變化有關。已經發現了兩類與癌症直接相關的基因,即原癌基因和抑癌基因。原癌基因的變化會導致腫瘤發生,而抑癌基因的作用是阻止細胞癌變。此外,許多基因與癌症的治療有關。例如,有些基因可以增強化療效果,使癌細胞對化療藥物敏感性增加,在同等劑量化療藥物作用下,殺死更多的癌細胞;還有人將造血生長因子基因導入造血幹細胞,以減輕因化療和放療造成病人造血功能的損害 ,因此更有利於對癌症的治療。然而,癌症的發病機制是極其複雜的,基因治療技術中的許多環節和問題仍然困擾著科學家。絕大部分研究是在實驗室里進行的,其效果雖然令人振奮,但套用到癌症患者效果卻不十分理想,基因治療中的許多關鍵問題尚有待解決。
其它療法
餓死癌細胞
所謂的把癌細胞餓死是通過手術阻斷人體對癌細胞供給。美國哈佛大學的朱達·福克曼博士早在七十年代就發現,癌細胞要想長成對生命有威脅的“塊頭”,就必須依賴血液提供營養,為此癌細胞與附近的毛細血管相接,從此獲取血液而“瘋長”。如果想辦法“勒死”癌細胞周圍的血管,癌細胞就會因得不到營養而被活活“餓死”。
像西醫肝癌的介入栓塞化療,就是通過將肝動脈堵塞,讓供肝癌的血液減少來控制癌細胞的生長,甚至使其因缺乏營養而死亡。英國牛津大學一個研究小組又發現一種餓死癌細胞的方法,他們展示了一項實驗室研究結果:使用核糖核酸RNA分子來直接影響二氫葉酸還原酶基因實現“突變”。這種酶是刺激癌症細胞迅速擴散的基本物質,當它的基因實現“突變”後,快速分裂的癌細胞將因缺乏基本化學物質胸腺嘧啶而被“餓死”。同時還可以有助於阻止新生成癌症細胞的生長。
至於為什麼將這種方法稱為:餓死癌細胞,就是為了讓普通老百姓都能很好地理解。所以“餓死癌細胞”是一種變種的民俗說法,並不是讓病人減少飲食營養,或不打白蛋白來“餓死癌細胞”。其實,不吃不喝的結果首先應該是餓死人,人死了血液停止流動才會將癌細胞餓死。
治療癌症一半靠藥力,一半靠自身免疫力。若身體虛弱,免疫力低下,再好的藥物也無法對癌症有效,反之,若飲食正常,消化力強,思想開朗,適當通過100微克補硒,免疫力就高,病就易治,且易於出現療效。
癌細胞自殺
 癌細胞
癌細胞美國科學家首次發現,利用一種合成分子可以誘使癌細胞“自殺”。這將使在未來制訂個性化癌症治療方案成為可能。
美國伊利諾伊大學的研究人員在最新一期《自然·化學生物》雜誌上報告說,多數細胞內都含有一種叫做半胱天冬酶-3酶原的蛋白。這種蛋白一旦被激活,就會轉化成一種稱為半胱胺酸蛋白酶-3的酶,導致有缺陷的或危險的細胞凋亡。然而,癌細胞中這種活化機制被破壞了,使其不會凋亡並最終發展成腫瘤。
負責這項研究的保羅·赫根羅德在一份聲明中說:“我們已找到一種合成分子,可直接激活半胱天冬酶-3酶原,使其轉化為半胱胺酸蛋白酶-3,從而導致癌細胞程式性死亡。”
研究人員說,他們篩選了2萬多種不同結構的合成分子,通過測試它們在細胞培養物和3種患癌小鼠身上的功效,才找到了這一簡稱為“PAC-1”的合成分子。對23份人體腫瘤樣本進行的實驗表明,“PAC-1”能殺死其中的癌細胞。
研究人員說,“PAC-1”的作用取決於半胱天冬酶-3酶原的數量。例如,在肺癌細胞中,半胱天冬酶-3酶原的數量比正常水平高5倍,因而“PAC-1”能更好發揮作用。赫根羅德認為,這意味著該療法的有效性可以預知,將來可根據半胱天冬酶-3酶原數量的差異為不同患者分別制訂最佳的醫療方案。
研究進展
2014年6月5日,清華大學宣布:清華大學醫學院顏寧教授研究組在世界上首次解析了人源葡萄糖轉運蛋白GLUT1的晶體結構,初步揭示了其工作機制及相關疾病的致病機理。該研究成果被國際學術界譽為“具有里程碑意義”的重大科學成就。
癌細胞要生存,需要依賴葡萄糖作為其“口糧”,而由於癌細胞消化葡萄糖所產生的能量不到普通細胞的15%,所以癌細胞就需要比正常細胞攝入更多的葡萄糖,也就需要通過負載更多的葡萄糖轉運蛋白GLUT1完成葡萄糖從細胞外轉運到細胞內的過程。
因此,如能研究清楚轉運蛋白GLUT1的組成、結構和工作機理,就有可能通過調控它實現葡萄糖轉運的人工干預,既可以增加正常細胞內葡萄糖供應達到治療相關疾病的目的,又可能通過特異阻斷對癌細胞的葡萄糖供應,達到抑制癌細胞生長的目標。
顏寧同時強調:“很多疾病都有著複雜的成因,尤其癌症是最複雜的疾病,而我們的科研是非常基礎的。從基礎科研到轉化中間有相當漫長的路。但是通過諸多基礎科研成果,逐步積累線索,可以更好地理解致病機理,期望最終有可能治癒疾病。”
端粒太長易患癌
據美國加州大學舊金山分校(UCSF)科學家領導的最新基因組研究揭示,兩個普通的基因變異會使染色體端粒變得更長,但也會大大增加患神經膠質瘤腦癌的風險。此前許多科學家認為,端粒的功能只是防止細胞老化,保持細胞健康。相關論文線上發表於最近的《自然—遺傳學》網站上。
2014年6月8日,這兩個基因變異是TERT(端粒逆轉錄酶)和TERC(端粒酶),51%的人攜帶TERT變異,72%的人攜帶TERC變異。這兩個基因都有調節端粒行為的功能,是維持端粒長度的酶,這種由大部分人所攜帶的風險基因變異還比較罕見。研究人員認為,這些變異基因攜帶者的染色體端粒更長,所以全體細胞更加強健,但也增加了患高等級神經膠質瘤(high-grade gliomas)的風險。
“餓死”癌細胞
中國浙江大學腫瘤研究所教授胡汛團隊發現的“餓死”癌細胞方法,發表在國際生物和醫學領域權威雜誌elife上,得到了國際著名腫瘤學者的肯定。2012年起,擁有30年臨床經驗的浙江大學醫學院附屬第二醫院放射介入科醫生晁明和胡汛團隊一拍即合,投入到對原發性肝細胞肝癌新型療法研究中,並將這種方法命名為 “靶向腫瘤內乳酸陰離子和氫離子的動脈插管化療栓塞術”,簡稱“TILA-TACE”。他們進行的臨床研究結果顯示: 用cTACE治療了37例病人,18例有效;用TILA-TACE治療了40例病人,40例有效——指有效反應率而非治癒。而且在這個臨床研究中用TILA-TACE治療的肝癌 都是難治型肝癌。
有效的專業含義:就是腫瘤對這項治療有反應,如果沒反應,就是無效。不要誤解為普通人的理解。
問:小蘇打治療癌症,除了肝癌,對哪些惡性腫瘤有效? 晁明: 本研究中有非常嚴格的定義,針對原發性的肝細胞肝癌患者。其他腫瘤,還需要進一步研究。
![癌細胞[變異的細胞] 癌細胞[變異的細胞]](/img/d/776/nBnauM3XxgjN4EjM5YjN2UTO1UTM1QDN5MjM5ADMwAjMwUzL2YzLxQzLt92YucmbvRWdo5Cd0FmLzE2LvoDc0RHa.jpg)
