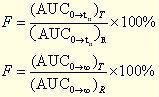定義
生物等效性(bioequivalency , BE )是指一種藥物的不同製劑在相同實驗條件下,給予相同的劑量,其吸收速度與程度沒有明顯差別。當吸收速度的差別沒有臨床意義時,某些藥物製劑其吸收程度相同而速度不同也可以認為生物等效。生物等效性與藥劑等效性(pharmaceutical equivalents )不同,藥劑等效性是指同一藥物相同劑量製成同一劑型,但非活性成分不一定相同,在含量、純度、均勻度、崩解時間、溶出速率符契約一規定標準的製劑。藥劑等效性不能反映藥物製劑在體內情況。 生物利用度或生物等效性的研究,反映了藥物製劑的生物學標準,為臨床療效提供直接證明。實際要求進行生物等效性研究的藥物主要有以下兩種。 ① 改變劑型的產品。
② 改變處方與工藝的產品。
新的生物等效性參數
生物等效性參數研究是一個十分複雜的系統工程,目前許多研究者都在探索更合適的評價生物等效性的參數。在生物等效性評價過程中,人們普遍認為,用auc代表藥物吸收的程度,不僅適用於單劑量和多劑量研究,而且適用於速釋和控釋製劑。但對選擇用於反映吸收速度的藥動學參數,則存在較多爭議。在多數國家藥政管理部門的指南中,仍將cmax和tmax作為反映吸收速度的考核指標。
美國basson認為,cmax測定的是藥物的最終吸收,而tmax能夠反映藥物的吸收速度,因此他提出在預計的吸收相內以等時間間隔采點來確定tmax,使其構成一個計數過程,這就為比較兩種或多種處方的吸收速度提供了理論基礎。同時,他還建議將cmax的作用限制為考察“突釋效應”,以評價藥物的安全性。
考慮到不同藥物體內過程的複雜性及緩控釋製劑的吸收代謝特性,俞鳳池教授和吳畏碩士認為,在評價藥物的生物等效性時,除考察auc、cmax和tmax之外,還應考慮半衰期(t1/2)、最小滯留時間(mrt)等其他藥動學參數。
研究常用的分析方法
色譜法:用於大多數藥物檢測
免疫法:多用於蛋白質多肽類物質檢測。
微生物學方法:可用於抗生素藥物的確定。
實驗步驟
一試驗設計與操作
1。交叉設計
2。受試者選擇
3。給藥劑量
4。取樣
5。參數計算。
6。標準化
二數據處理和統計分析
1。數據表達
2。藥代動力學參數
3。統計分析
三結果的評價。