 標準摩爾生成焓
標準摩爾生成焓概述
 生成焓設備
生成焓設備 焓是工質在某一狀態下所具有的總能量,它是內能U和壓力勢能(流動能)PV之和,是一個複合狀態參數,其定義式為H=U+PV。焓用符號H表示,其單位為J或kJ。1千克工質的焓稱為比焓,用符號h表示,單位為J/kg或kJ/kg,則比焓為h=u+pv。因為焓是由狀態參數u、p、v組成的綜合量,對工質的某一確定狀態,u、p、v均有確定的數值,因而u+pv的數值也就完全確定。所以,焓是一個取決於工質狀態的狀態參數,它具有狀態參數的一切特徵。
標準生成焓
 生成焓化學式
生成焓化學式是無機化學或者物理化學的內容,本人化工相關專業畢業,還記得一些(有標準燃燒焓各式相加減得出):
試由 C(石墨)、H2(g) 和 CH4(g) 的標準燃燒焓[變]數據估算 CH4(g) 的標準生成焓[變]。
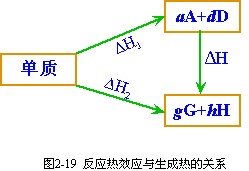
按 CH4(g) 的標準摩爾生成焓[變]即為以下反應的熱效應: 而由式(2-115):
又對於反應:
一些有機化合物的標準燃燒焓[變]
有機化合物名稱 分子式 (kJ·mol-1) 有機化合物名稱 分子式 (kJ·mol-1)
甲烷(g) CH4 -890.34 苯(l) C6H6 -3267.7
乙烷(g) C2H6 -1559.8 甲苯(l) C7H8 -3910.0
丙烷(g) C3H8 -2220.1 苯(s) C10H8 -5138.8
正一丁烷(g) C4H10 -2878.6 蔗糖(s) C12H22O11 -5643.9
正一戊烷(g) C5H12 -3536.2 甲醇(s) CH3OH -726.65
乙烯(g) C2H4 -1411.0 乙醇(s) C2H5OH -1366.9
乙炔(g) C2H2 -1299.7 乙酸(l) CH3COOH -871.72
苯(g) C6H6 -3293.7 苯甲酸(s) C6H5COOH -3226.8
查 298.15K 下表值:
故:套用燃燒焓[變]計算熱效應時,往往遇到由較大的數值差減以獲得較小的數值,這樣必然會引入較大的誤差,因此這種計算方法往往不如生成焓法準確。