定義
在一定溫度壓力下,純溶質B溶解在純溶劑A中形成一定組分的溶液,其過程的焓變稱為B的溶解焓,以符號△solH表示。
原理
溶解焓熱力學中表示物質系統能量的一個狀態函式,常用符號△solH表示。溶解焓的變化是系統在溶解過程中所吸收的熱量的度量。 物體中所有分子做熱運動的動能和分子勢能和分子、原子內部所具有的能量等的總和叫做物體的熱力學能,也叫做內能。熱力學能與動能、勢能一樣,是物體的一個狀態量。

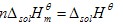
一定溫度下溶質的標準摩爾溶解焓除了與溶劑的種類有關外,還有溶液組成的函式。壓力對溶解焓的影響是很小的。 嚴格來講,應是摩爾積分溶解焓,以區別摩爾微積分溶解焓。摩爾微分溶解焓是在溶液組成不變的條件下,向溶液中加入溶質溶解後的焓變與加入的溶質的物質量之比。
作用
套用狀態函式法可以由溶質生成不同組成溶液時的摩爾溶解焓,求算在某一定組成的溶液中再加入溶質生成另一定組成溶液時的焓變。
用例
通常文獻上給出的是在常壓下25℃或其他溫度時溶質溶於水中形成不同組分水溶液時的摩爾溶解焓。以LiCl(s)在水中的摩爾溶解焓為例,見表。表中r為溶質LiCl的摩爾比。
| 1/r | 2.79 | 3.13 | 3.57 | 4.00 | 4.76 | 5.88 | 7.69 |
| △solHm(kJ/mol-1) | -19.347 | -21.221 | -23.380 | -25.083 | -27.393 | -29.560 | -31.485 |
| 1/r | 12.5 | 20.0 | 50.0 | 100 | 200 | 400 | ∞ |
| △solHm(kJ/mol-1) | -33.535 | -34.581 | -35.564 | -35.941 | -36.233 | -36.43 | -36.89 |
