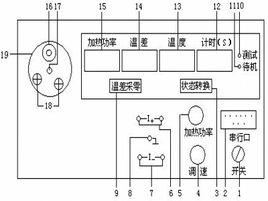
簡介
溶質的量為1摩爾時的溶解熱叫做摩爾溶解熱。
由於在純溶劑中或某一濃度的溶液中溶解相同物質的溶質嚴格說其溶解熱是不一樣的,所以溶解熱分為:
積分溶解熱:在恆溫恆壓下,一摩爾溶質溶於n摩爾溶劑中產生的熱效應,用Qs表示。
微分溶解熱:在恆溫恆壓下,一摩爾溶質溶於某一確定濃度的無限量的溶液中產生的熱效應
沖淡熱:在恆溫恆壓下,1mol溶劑加到某濃度的溶液中使之沖淡所產生的熱效應,沖淡熱也可以分為積分(或變濃)沖淡熱,和微分(或定濃)沖淡熱兩種。
積分沖淡熱:在恆溫恆壓下,把願含有1mol溶質和n摩爾溶劑的溶液沖淡到喊溶劑為n時的熱效應,亦即為某溶液在兩種濃度下的積分溶解熱之差,以Qd表示。
微分沖淡熱:在恆溫恆壓下,1mol溶劑加入某一確定濃度的無限量的溶液中產生的熱效應。
在溶液中加入純溶劑所引起的熱效應稱為稀釋熱。稀釋熱也可分為積分稀釋熱和微分稀釋熱。
1.積分溶解熱:在恆溫恆壓下,一摩爾溶質溶於n摩爾溶劑中產生的熱效應,用Qs表示。
2.微分溶解熱:在恆溫恆壓下,一摩爾溶質溶於某一確定濃度的無限量的溶液中產生的熱效應
3.沖淡熱:在恆溫恆壓下,1mol溶劑加到某濃度的溶液中使之沖淡所產生的熱效應,沖淡熱也可以分為積分(或變濃)沖淡熱,和微分(或定濃)沖淡熱兩種。
4.積分沖淡熱:在恆溫恆壓下,把願含有1mol溶質和n摩爾溶劑的溶液沖淡到喊溶劑為n時的熱效應,亦即為某溶液在兩種濃度下的積分溶解熱之差,以Qd表示。
5.微分沖淡熱:在恆溫恆壓下,1mol溶劑加入某一確定濃度的無限量的溶液中產生的熱效應。
6.稀釋熱
有些物質溶解時明顯要放熱,例如NaOH、濃HSO,有些明顯要吸熱,例如NHNO、NHCL。
原理
在特定條件下一定量溶質溶於一定量溶劑時產生的熱效應。影響物質溶解熱的主要因素有溫度、壓力、溶質量和溶劑量。溶解熱通常用298.15K和1大氣壓下1摩爾溶質溶於一定量溶劑的熱效應來表示,單位為焦/摩爾。根據物質溶解過程中溶液濃度是否發生變化,溶解熱又可分為積分溶解熱和微分溶解熱,前者是1摩爾溶質溶解在 n摩爾溶劑中所產生的熱效應,在溶解過程中溶液濃度逐漸改變 。微分溶解熱是一種定濃度的溶解熱,可以認為是把1摩爾溶質溶於大量的、一定濃度的溶液時所產生的熱效應,或者在一定量溶液中加入極少量的d n摩爾溶質時產生的熱效應。積分溶解熱與微分溶解熱的關係表示為:
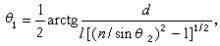 、
、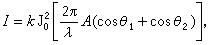 溶解熱
溶解熱如果考慮一個在恆溫恆壓下由 n摩爾溶質和 n摩爾溶劑所組成的二元體系,則積分溶解熱的變化為:
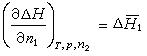 溶解熱
溶解熱式中偏導,它是溶質2的微分溶解熱;偏導,它是溶劑1的微分溶解熱。
上式又可寫為:
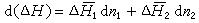 溶解熱
溶解熱在物質溶解過程中,由於溶質和溶劑的本質及其相對含量的不同,有的吸熱(如硝酸銨溶於水);有的放熱(如硫酸加水稀釋)。
物質的溶解熱可用各種不同類型的量熱器直接測量,測得的結果實際上是積分溶解熱。根據不同濃度下的積分溶解熱數值,可利用作圖法求得微分溶解熱。具體方法是以積分溶解熱作縱坐標,溶質的摩爾數作橫坐標,繪出熱效應曲線,曲線上任一點的正切,便是該濃度下溶質的微分溶解熱。