溶液pH的電位測定法
正文
當一個 pH 指示電極(如玻璃電極)和一個參比電極插入被測溶液時,參比電極與指示電極間的電位差V決定於溶液的pH。25℃時兩者的關係為:V=b+0.0592pH
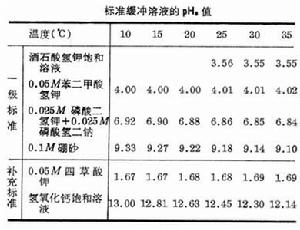
式中 b為常數。利用pH計(見彩圖) 測定溶液的pH時,要先用已知pH值的緩沖溶液校準儀器,這時的電位差VS為:
測定溶液的pH時,要先用已知pH值的緩沖溶液校準儀器,這時的電位差VS為: VS=b+0.0592pHS
然後再測定未知溶液的pH:Vu=b+0.0592pH
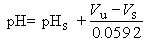
 溶液pH的電位測定法
溶液pH的電位測定法① 在被測的緩衝溶液中加入少許一定量的可溶性氯化物,在溶液中插入氫電極和銀│氯化銀電極,然後測定電池的電動勢E:
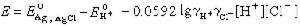
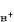 和γ扲 分別為 H+和 Cl-的活度係數,
和γ扲 分別為 H+和 Cl-的活度係數,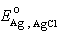 和
和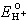 為標準電極電位,令PWH為:
為標準電極電位,令PWH為: 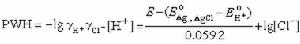
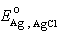 、
、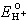 、【Cl-】都可測定,所以PWH即可求得。
、【Cl-】都可測定,所以PWH即可求得。 ② 當【Cl-】小於0.015Μ時,PWH對【Cl-】作圖, 得一直線。在不同的【Cl-】值時求出PWH值,並以PWH值對【Cl-】作圖,求出【Cl-】=0時的PWH值(以PWH0表示)則得:
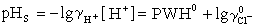
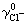 ,在25℃時:
,在25℃時: 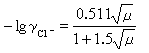
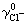 就可以求出pHS。
就可以求出pHS。
