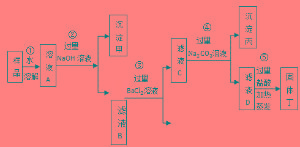
反應過程
將飽和的食鹽溶液在冷卻時用氨飽和,後在加壓下通入CO2(由CaCO3分解而來),由於NaHCO3溶解度較小而析出,將析出的NaHCO3晶體煅燒,即可製得碳酸鈉.母液中的氯化銨加消石灰回收氨,以便循環利用.制氨鹽水先通入氨氣,再通二氧化碳。因為氨氣的溶解度大,若先通二氧化碳則有大部分沒有溶解到海水中。
鹽水---精鹽水----氨鹽水----碳酸氫鈉-----純鹼
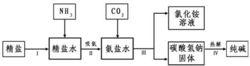 氨鹼法示意圖
氨鹼法示意圖反應方程式為:(1)NH3+H2O+CO2=NH4HCO3
(2) NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3=加熱=Na2CO3+H2O+CO2↑
即:(1)NaCl(飽和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓
(2)2NaHCO3=加熱=Na2CO3+H2O+CO2↑
優缺點
此法的優點是原料經濟,能連續生產,副產物NH3和CO2可回收使用,但缺點是大量的CaCl2用途不大,NaCl利用率只有70%左右,約有30% NaCl留在母液中.
侯氏制鹼法
聯合 制鹼法是我國化學家侯德榜先生於四十年代研究成功的 制鹼新工藝,又稱"侯氏 制鹼法".與氨鹼法相比,聯合 制鹼法工藝進步了很多.此法保持了氨鹼法的優點,消除了它的缺點.一方面使食鹽的利用率提高到96%;另一方面生產出的NH4Cl可做氮肥.是一種 制鹼和制氨相結合的聯合生產方法.
反應過程
將飽和的食鹽溶液在冷卻時用氨飽和,後在加壓下通入二氧化碳(由CaCO3分解而來),由於NaHCO3溶解度較小而析出,將析出的NaHCO3晶體煅燒,即可製得碳酸鈉.根據氯化銨在常溫時的溶解度比氯化鈉大,而在低溫時卻比氯化鈉溶解度小的原理,向母液中加入磨細的食鹽粉末,產生同離子效應而使氯化銨單獨結晶出來.
優點
①原料利用率高.實驗利用率可達96~97%.
②省掉了氨鹼法中的石灰石與焦碳兩種原料.
③不需要建回收氨的設備,節省基建費.
④無大量廢渣廢液排出,有利於保護環境.
⑤同時生產化肥和純鹼,經濟效益高.
缺點
①生產過程中,設備利用率低,動力消耗大.
②需精製食鹽,需預處理工序.
③由於循環母液中含NH4Cl 的濃度高,設備腐蝕嚴重,因此需要防腐蝕材料.