實驗目的
1.掌握溶解、過濾、蒸發等實驗的操作技能。
2.理解過濾法分離混合物的化學原理。
3.體會過濾的原理,在生活生產等社會實際中的套用。
4.製取精鹽。
儀器藥品
藥品:粗鹽、蒸餾水、BaCl溶液、NaOH溶液、NaCO溶液、鹽酸
器材:托盤天平(含砝碼),量筒,燒杯,玻璃棒,藥匙,漏斗,濾紙,鐵架台(帶鐵圈),蒸發皿,酒精燈,坩堝鉗,膠頭滴管,研缽,研杵,火柴,若干一樣的小紙片
實驗步驟
過程
用托盤天平稱取2克粗鹽(精確到0.1克)。用量筒量取10毫升水倒入燒杯里。用藥匙取一匙粗鹽加入水中,並用玻璃棒攪拌,觀察現象(玻璃棒的攪拌對粗鹽的溶解起什麼作用?攪拌,加快溶解速度)。接著再加入粗鹽,邊加邊用玻璃棒攪拌,一直加到粗鹽不再溶解時為止。觀察溶液是否變渾濁。
1.在天平上稱量剩下的粗鹽,計算在10毫升水中大約溶解了多少克粗鹽。
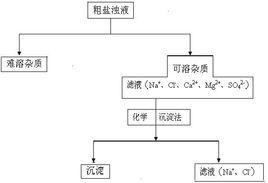
 粗鹽提純
粗鹽提純2.加入過量BaCl(去除硫酸根離子)BaCl+NaSO==BaSO↓+2NaCl
3.加入過量NaOH(去除鎂離子)MgCl+2NaOH==Mg(OH)↓+2NaCl
4.加入過量NaCO(去除鈣離子及BaCl2中的鋇離子) NaCO+CaCl==CaCO↓+2NaCl
5. NaCO+BaCl==BaCO↓+2NaCl
(註:可互換2,3兩步或3,4兩步。NaCO的用量一定要將所有的BaCl除去,可使用pH試紙控制加入量。)
6過濾
向濾液中加入適量HCl(除去過量NaOH,NaCO,可選擇用pH試紙控制加入的量,或是直接蒸發)
7.蒸髮結晶
過濾注意事項
將濾紙摺疊後用玻璃棒蘸水潤濕使其緊貼漏斗內壁並使濾紙上沿低於漏斗口,溶液液面低於濾紙上沿,傾倒液體的燒杯口要緊靠玻璃棒,玻璃棒的末端緊靠有三層濾紙的一邊,漏斗末端緊靠盛接濾液的燒杯的內壁。慢慢傾倒液體,待濾紙內無水時,仔細觀察濾紙上的剩餘物及濾液的顏色。濾液仍渾濁時,應該再過濾一次。
如果經兩次過濾濾液仍渾濁,則應檢查裝置並分析原因。例如,濾紙破損,過濾時漏斗里的液面高於濾紙邊緣,儀器不乾淨等。找出原因後,要重新操作。
過濾時要注意一貼二低三靠。
①“一貼”是指濾紙摺疊角度要與漏斗內壁口徑吻合,使濕潤的濾紙緊貼漏斗內壁而無氣泡,因為如果有氣泡會影響過濾速度。
②“二低”一是指濾紙的邊緣要稍低於漏斗的邊緣,二是在整個過濾過程中還要始終注意到濾液的液面要低於濾紙的邊緣。這樣可以防止雜質未經過濾而直接流到燒杯中,這樣未經過濾的液體與濾液混在一起,而使濾液渾濁,沒有達到過濾的目的。
③“三靠”一是指待過濾的液體倒入漏斗中時,盛有待過濾液體的燒杯的燒杯嘴要靠在傾斜的玻璃棒上(玻璃棒引流),防止液體飛濺和待過濾液體衝破濾紙;二是指玻璃棒下端要輕靠在三層濾紙處以防碰破濾紙(三層濾紙一邊比一層濾紙那邊厚,三層濾紙那邊不易被弄破);三是指漏斗的頸部要緊靠接收濾液的接受器的內壁,以防液體濺出。
蒸發的具體過程
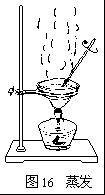 粗鹽提純
粗鹽提純把得到的澄清濾液倒入蒸發皿。把蒸發皿放在鐵架台的鐵圈上,用酒精燈加熱(圖16)。同時用玻璃棒不斷攪拌濾液(均勻受熱,防止液體飛濺)。
等到蒸發皿中出現大量固體時,停止加熱。利用蒸發皿的餘熱使濾液蒸乾。
產率計算
將提純後的氯化鈉與粗鹽作比較,計算精鹽的產率。
(誤差分析:明顯偏低:A.溶解時將粗鹽一次全部倒入水中,立即過濾B.蒸發時,有一些液體、固體濺出。C.固體沒有完全被轉移到紙上。
偏高:提純後的精鹽尚未完全乾燥就稱其質量.粗鹽中含有其他可溶性固體。)
玻璃棒的作用
本實驗5次用到玻璃棒。
1.溶解時:攪拌,加速溶解。
2.過濾前:蘸水潤濕濾紙。
3.過濾時:引流。
4.蒸發時:攪拌,使液體均勻受熱,防止液體飛濺。
5.計算產率時:用玻璃棒把固體轉移到紙上。
(注意玻璃棒攪拌時不要碰到杯壁)
元素變化
反應前:NaCl、MgCl、CaCl、NaSO
加入BaCl(過量)產生BaSO沉澱 溶液內還剩:NaCl、MgCl、CaCl、BaCl
加入NaOH(過量)產生Mg(OH)沉澱 溶液內還剩:NaCl、CaCl₂、NaOH
加入NaCO(過量)產生CaCO沉澱和BaCO沉澱 溶液內還剩:NaCl、NaCO
加入HCl(過量)產生CO、HO 溶液內還剩:HO、HCl、NaCl
加熱後:NaCl、HO
蒸發後:NaCl
實驗現象
溶解:粗鹽固體為灰色,加入水中所得液體呈渾濁狀。
過濾:濾液是無色透明液體,濾紙上的殘留物呈黑色。
蒸發:隨著加熱,蒸發皿中液體的量減少;當蒸發到一定程度時,蒸發皿底部有固體析出。蒸發得到的固體為白色。