反應基本現象
紅磷與KClO的混合物極為敏感,在存放過程中不需要外界刺激就有可能自燃爆炸,有人認為P-KClO反應是兩步進行的,即KClO首先分解放出氧,然後是O與P的反應放熱最後自燃,但是DSC分析結果證明這個假設是錯誤的:P-KClO的反應峰出現在KClO分解之前。因此P-KClO反應只能從固相機理去解釋。
反應原理
P-KClO反應的機理是P碎片侵入KClO晶格導致KClO晶格鬆弛,從而降低了發火溫度。當P-KClO混合物存放時,P首先遇到空氣發生緩慢的氧化作用,這一表面的氧化是緩慢的,在純P中同樣存在,不足以引起自燃,但這一氧化使得P表面產生大量的P碎片,它侵入KClO晶格內,使KClO晶格鬆弛,同時也造成KClO晶體出現其他缺陷,活化能降低。隨著大量P碎片的侵入,KClO的缺陷和活性區不斷增加反應熱積累,由於這一過程在低溫下就能進行,所以最終導致自燃。從晶格擴散和離子表面遷移率可以計算出P-KClO體系的最低自燃溫度為42度(稱為Tamman溫度),只要體系溫度高於42度,一段時間後必然引發自燃,但並不是說低於42度體系就是安全的,混合物在空氣中的緩慢氧化、受到摩擦或震動等都會導致體系內出現一系列熱點,而導致自燃爆炸。
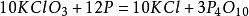 氯磷
氯磷反應化學方程式:
實驗安全提示
該反應十分危險,請不要輕易嘗試。大劑量時可能會造成身體傷害,做本實驗時請準備好護目鏡等安全設施,不要在人多的地方操作。紅磷與氯酸鉀都是國家嚴格管制的化學藥品。

