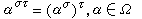氣體比熱容
正文
描述氣體同外界交換熱量時,體系溫度變化特性的物理量。計算由 N個同類分子組成的理想氣體系統的比熱容,通常先求出玻耳茲曼統計中分子的配分函式q: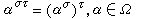
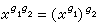 在體積V保持不變的情況下對溫度T求導得出定容熱容:
在體積V保持不變的情況下對溫度T求導得出定容熱容: 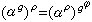
對理想氣體,根據熱力學公式
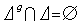
分子由原子組成,原子由原子核和核外電子組成,配分函式的分子能級εi中應包含這些組成因素。原子核由於自鏇方位不同的各態之間能量差,在產生原子光譜中是一種超精細結構,且核自鏇同電子殼層的相互作用極其微弱,所以其影響在熱力學過程中一般可以忽略。電子則由於所處的最低能級同最鄰近的次高能級之差遠比nT為大,激發它很困難,當溫度改變時,它仍處在基態,對於熱容就沒有貢獻。在不考慮具有核衰變的原子的情況下,配分函式公式中的εi只有分子作為整體的質心平動、整體的轉動和內部原子間的相對振動這三部分的能量。①平動部分。平動能級的相對間距微不足道,分子作熱運動時總可看作是連續的,所以平動部分對熱容的貢獻可用能量均分定理來處理。分子的平動自由度對定容熱容的貢獻是
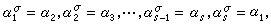 而定容摩爾比熱容是
而定容摩爾比熱容是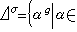 (以下均指定容摩爾比熱容),R 是摩爾氣體常數。②轉動部分。組成多原子分子的原子愈重或數量愈多,轉動慣量就愈大,轉動的量子效應也就愈顯現不出來。一般只考慮低溫下較輕雙原子分子氣體轉動的量子性;其他多原子分子或重原子的雙原子分子一般可作經典處理。③振動部分。絕大多數的多原子分子在常溫下振動能級間距比熱運動能量kT大得多,也不容易激發它參與熱運動,所以對比熱容也沒有貢獻;只有在高溫時才有貢獻;溫度再高時可作經典處理。事實上,多於兩個原子組成的氣體分子幾乎都不可能達到經典處理時的溫度,因為這時多原子分子已經分解了。
(以下均指定容摩爾比熱容),R 是摩爾氣體常數。②轉動部分。組成多原子分子的原子愈重或數量愈多,轉動慣量就愈大,轉動的量子效應也就愈顯現不出來。一般只考慮低溫下較輕雙原子分子氣體轉動的量子性;其他多原子分子或重原子的雙原子分子一般可作經典處理。③振動部分。絕大多數的多原子分子在常溫下振動能級間距比熱運動能量kT大得多,也不容易激發它參與熱運動,所以對比熱容也沒有貢獻;只有在高溫時才有貢獻;溫度再高時可作經典處理。事實上,多於兩個原子組成的氣體分子幾乎都不可能達到經典處理時的溫度,因為這時多原子分子已經分解了。 經典統計處理 用能量均分定理計算定容摩爾比熱容。若分子由N個原子組成,就有3N個自由度,其中質心平動自由度有3個,平動能ε
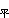 有三個二次方項,對摩爾比熱容的貢獻為
有三個二次方項,對摩爾比熱容的貢獻為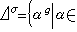 。線型分子有兩個轉動自由度,轉動能ε轉有兩個二次方項,對摩爾比熱容的貢獻為R;非線型分子有三個轉動自由度,總可以找到三個主轉動慣量軸,使轉動能ε轉有三個二次方項,所以對摩爾比熱容的貢獻為
。線型分子有兩個轉動自由度,轉動能ε轉有兩個二次方項,對摩爾比熱容的貢獻為R;非線型分子有三個轉動自由度,總可以找到三個主轉動慣量軸,使轉動能ε轉有三個二次方項,所以對摩爾比熱容的貢獻為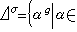 。剩下的3N-5或3N-6個是振動自由度,總可找到一種簡正坐標,使振動能ε振具有3N-5或3N-6個二次方項,於是分子內部諸原子的相對振動自由度對摩爾比熱容的貢獻為:線型分子是(3N-5)R,非線型分子是(3N-6)R。
。剩下的3N-5或3N-6個是振動自由度,總可找到一種簡正坐標,使振動能ε振具有3N-5或3N-6個二次方項,於是分子內部諸原子的相對振動自由度對摩爾比熱容的貢獻為:線型分子是(3N-5)R,非線型分子是(3N-6)R。 量子統計處理 在經典處理不適用時,就要計算配分函式q。若平、轉、振三部分自由度是互相獨立的,則可寫為εi=ε
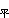 +ε轉+ε振,從而內能是各部分內能相加,也就可以分別地用定容熱容公式求對摩爾比熱容的貢獻。
+ε轉+ε振,從而內能是各部分內能相加,也就可以分別地用定容熱容公式求對摩爾比熱容的貢獻。 ①轉動部分。因一般只考慮雙原子分子情形。對不同原子的雙原子分子有
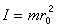 是分子的轉動慣量,
是分子的轉動慣量,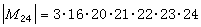 是折合質量,ro是兩個原子核之間的平衡距離。令
是折合質量,ro是兩個原子核之間的平衡距離。令 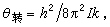
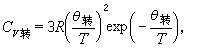
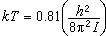 時有一個極大值,然後漸近地趨向於經典值。
時有一個極大值,然後漸近地趨向於經典值。  氣體比熱容
氣體比熱容② 振動部分。由於原子之間通過化學鍵耦合得很強,所以內部原子的相對振動不屬於哪一個原子,而是N 個原子集體的振動模式,故有3N-5或3N-6個自由度,也就有那么多的簡正振動。每一種簡正振動α(α=1,2,...,3N-5或3N-6)有它自己的振動頻率vα,若某些頻率一樣,則頻率是簡併的。在簡諧近似下,簡正振動都是獨立的,所以振動能量就是各個振動能量之和:
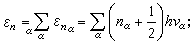
nα是屬於簡正振動α的振動量子數(nα=0,1,2,...),而配分函式
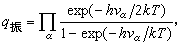
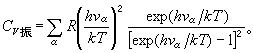
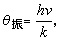
 時,Cv
時,Cv =R,同經典結果一樣
=R,同經典結果一樣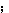 而在T<<θ
而在T<<θ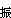 時,可得
時,可得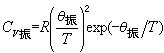 ,隨著溫度的降低而Cv振→0。圖2描繪了雙原子分子氣體Cv振/R 依賴於T/θ振的關係。
,隨著溫度的降低而Cv振→0。圖2描繪了雙原子分子氣體Cv振/R 依賴於T/θ振的關係。 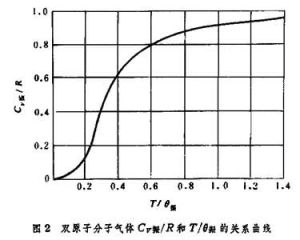 氣體比熱容
氣體比熱容