定義
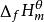 標準生成焓變化
標準生成焓變化化學熱力學規定,某溫度下,由處於標準狀態下的各種元素的指定單質,生成標準狀態下的1mol某純物質的熱效應,叫做該溫度下該物質的標準摩爾生成熱。或簡稱標準生成熱。由於標準狀態下,定溫定壓,所以生成熱等於焓變。所以又可稱為標準生成焓變化,簡稱標準生成焓。標準生成焓變化的符號為 ,f表示生成,下標m表示反應進度為ε=1mol,上標Θ表示標準狀態。單位是kJ/mol或kJ·mol 。
但有少數例外,例如,磷的最穩定單質是黑磷,其次是紅磷,最不穩定的是白磷,但是磷的指定單質是白磷。因為白磷比較常見,結構簡單,易製得純淨物。
性質
1.標準摩爾生成焓在使用時必須註明溫度。
2.單質的標準摩爾生成焓為零。根據定義,由穩定單質生成穩定單質,也就是由自己生成自己,沒有發生變化,所以焓變為0,因此穩定單質的標準摩爾生成焓為零。穩定單質大體包括(標態):全部金屬單質、惰性氣體單質、第二周期元素常見單質(除臭氧)、鹵族元素單質、某些元素同分異構體:C石墨、P白磷、S斜方。
3.除了NO、NO、CH(氣)等少數物質以外,絕大多數常見化合物的標準摩爾生成焓都是負值。這反映一個事實,即由單質生成化合物時一般都是放熱的,而化合物分解成單質時通常是吸熱的。
套用
計算標準反應焓
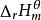 標準生成焓變化
標準生成焓變化對任一化學反應,利用各種反應物和生成物的標準摩爾生成焓變的數據,就可以求得該反應的標準摩爾反應焓變 。物質的標準摩爾生成焓變的數值可從各種化學、化工手冊或熱力學數據手冊中查到。
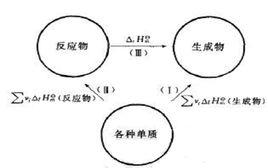
可以通過設定路徑來計算反應的摩爾焓變。對任何一個化學反應來說,其反應物和生成物的原子種類和個數是相同的,因此可以用同樣的穩定單質來生成反應物和生成物。例如對反應dD+eE=gG+hH,設定路徑如圖1所示。
根據Hess定律,若把參加反應的各穩定單質定為始態,把反應的生成物定為終態,則途徑1和途徑2的反應焓變應相等,所以:
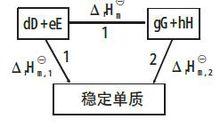 圖1
圖1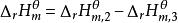 標準生成焓變化
標準生成焓變化因:
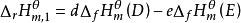 標準生成焓變化
標準生成焓變化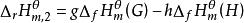 標準生成焓變化
標準生成焓變化所以:
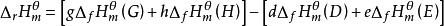 標準生成焓變化
標準生成焓變化即:
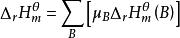 標準生成焓變化
標準生成焓變化即一定溫度下,化學反應的標準反應焓變化,等於同溫度下產物的標準生成焓變化之和減去反應物的標準摩爾生成焓變化之和。
常見物質的標準生成焓
圖2為常態物質的標準生成焓數值。
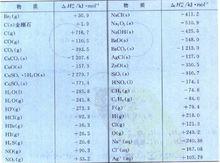 圖2
圖2