定義
 標準摩爾生成自由能
標準摩爾生成自由能在規定溫度,標準壓力p下,穩定單質生成1mol物質時自由能的變化就是該物質的標準摩爾生成自由能,用符號ΔG (T)表示,298K的標準生成自由能的符號可以省去(T)表示,其單位是kJ·mol 。
性質
 標準摩爾生成自由能
標準摩爾生成自由能1.單質的標準摩爾生成焓為零。根據定義,由穩定單質生成穩定單質,也就是由自己生成自己,沒有發生變化,所以焓變為0,因此穩定單質的標準摩爾生成焓為零。穩定單質大體包括(標態):全部金屬單質、惰性氣體單質、第二周期元素常見單質(除臭氧)、鹵族元素單質、某些元素同分異構體:C石墨、P白磷、S斜方。
2.對於有離子參加的反應,溶質的濃度主要用質量摩爾濃度,此時規定的標準態為
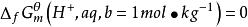 標準摩爾生成自由能
標準摩爾生成自由能套用
查表
通過查表可以找出物質在298.15K的標準生成自由能。
| 物質 | ΔG | 物質 | ΔG | 物質 | ΔG | 物質 | ΔG |
| AgCl(s) | -109.80 | AgBr(s) | -96.9 | AgI(s) | -66.19 | AgO(s) | -11.2 |
| Ag2CrO4(s) | -641.83 | AgNO3(s) | -33.47 | AlCl3(s) | -628.9 | Al2O3(s) | -124.4 |
| BaSO4(s) | -1138 | BaCl2(s) | -810.4 | BaO(s) | -520.41 | BaCO3(s) | -1138 |
| CaF2(s) | -1167 | CaCl2(s) | -748.1 | CaO | -604.04 | Ca(OH)2 | -898.56 |
| CaCO3(s) | -1128.8 | CaSO4(s) | -1321.9 | CO(g) | -137.5 | CO2(g) | -386.0 |
| Co(OH)2 | -454.4 | Cr2O3(s) | -1058 | CuS(s) | -53.6 | Cu2S(s) | -86.2 |
| CuSO4(s) | -661.9 | CuSO4·5H2O(s) | -1880.06 | Fe2O3(s) | -742.2 | Fe3O4(s) | -1015.46 |
| HCl(g) | -95.30 | HBr(g) | -53.43 | HI(g) | 1.30 | HgO(s) | -58.56 |
| HgCl2(s) | -179 | Hg2Cl2(s) | -210.78 | KCl(s) | -409.2 | KI(s) | -324.89 |
從上表可以看出,絕大多數準標準摩爾生成自由能都是負值,只有少數物質是正的。
判斷反應進行
可以利用各物質的標準摩爾生成自由能ΔG ,來計算出化學反應的標準摩爾吉布斯自由能ΔG ,並由吉布斯自由能判斷反應是否能自發進行。
計算公式為:ΔG =∑ΔG (產物)-∑ΔG (反應物)或寫成ΔG =∑v(B)ΔG (B)
例如,室溫下NHCl(s)在標態下是穩定的,分解不能自發進行,以下通過計算來驗證:
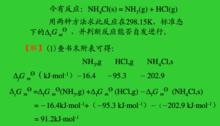 標準摩爾生成自由能
標準摩爾生成自由能公式推導
從穩定單質帶生成物(產物)的途徑有兩種,一種是直接到終態即生成物,以穩定的單質為相對標誌,此時的生成物的標準摩爾生成自由能就是ΔG (產物);還有一種途徑是先由單質變為所求反應的反應物,此時的反應物的標準生成標誌摩爾自由能是ΔG (反應物),然後再由反應物變為生成物即反生所求反應,此時反應的標準吉布斯自由能是ΔG
由於吉布斯自由能是狀態函式其改變值與途徑無關,所以ΔG +∑ΔG (反應物)=∑ΔG (產物),移項即得利用標準摩爾生成自由能的變化值ΔG 求解出標準摩爾吉布斯自由能變化值ΔG 的公式。

