焓和反應焓變
焓又稱熱函,是熱力學函式之一,也是體系的狀態函式之一。通常用 符合“H”表示。焓的定義是H=U+PV,式中U、P、V分別是體系的內能、壓力和體積。焓的因次與能量相同,為焦耳(J)。
焓是體系狀態的單值函式,其增量△H=H-H(即終態H減去始態H),即成為反應焓變,僅決定於體系的始態和終態,而與變化的途徑無關。在等壓且只做膨脹功的條件下,可得△H=△U+P△V= Q,這表示在上述情況下,體系所吸收的熱等於體系焓的增量。對於微小的恆壓而無非體積功的過程,則有dQ=dH。
相關定義
放熱反應和吸熱反應
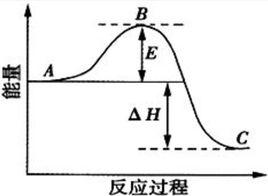
 反應過程中能量變化曲線圖
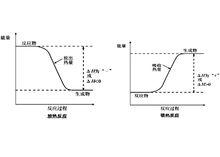
反應過程中能量變化曲線圖 化學反應中放出熱量的反應成為放熱反應。在放熱反應中,反應物具有的總能量大於生成物具有的總能量,其生成物分子成鍵時釋放出的總能量大於反應物分子斷裂時吸收的總能量,△H0。常見的分解反應有:以C、CO為還原劑的氧化還原反應(燃燒除外)、八水合氫氧化鋇和氯化銨的反應以及大多數分解反應如:CaCO高溫分解。
蓋斯定律
對於一個化學反應,無論是一步完成還是分幾步完成,其反應焓變都是一樣的。這就是蓋斯定律。其本質為:化學反應的焓變只與反應體系的始態和終態有關,與反應進行的具體途徑無關。套用蓋斯定律可以間接的計算一些難以通過實驗測量的反應的焓變。
反應焓變的計算
計算依據
反應焓變計算的主要依據是熱化學方程式、蓋斯定律等相關數據。
套用技巧
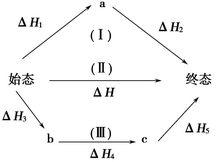 反應焓變的計算
反應焓變的計算 化學反應的熱效應只與始態、終態有關,與反應過程無關,反應熱總值一定。如下圖表示始態到終態的反應熱,則△H=△H+△H=△H+△H+△H。
化學反應遵循質量守恆和能量守恆。在指定的狀態下,各種物質的焓值都是確定,因此反應不論是一步完成,還是分步完成,最初的反應物和最終的產物都是一樣的。反應物和反應產物的焓的差值都是一樣的。
常用計算方法
(1)根據熱化學方程式進行計算:焓變與反應物各物質的物質的量成正比;
(2)根據反應物和生成物的總焓計算:ΔH=H(反應產物)-H(反應物);
(3)依據反應物化學鍵斷裂與生成物化學鍵形成過程中的能量變化計算:ΔH=反應物的化學鍵斷裂吸收的能量-生成物的化學鍵形成釋放的能量;
(4)根據蓋斯定律的計算;
(5)根據比熱公式求算:Q=-c·m·ΔT。
計算時應注意的問題
(1)反應焓變的數值與各物質的係數成正比。因此熱化學方程式中各物質的係數改變時,其反應焓變的數值需同時做相同倍數的改變。
(2)正、逆反應的反應熱焓變的數值相等,符號相反。
(3)熱化學方程式與數學上的方程式相似,可以移項同時改變正負號,各項的係數包括ΔH的數值可以同時擴大或縮小相同的倍數。
(4)多個熱化學方程式可以相加或相減,ΔH也進行相應的相加或相減,得到一個新的熱化學方程式。
(5)熱化學方程式中的反應焓變是指反應按照所給形式進行完全時的反應焓變。
蓋斯定律的套用
蓋斯定律的套用價值在於可以根據已準確測定的反應焓變來求實驗難測或根本無法測定的反應焓變,可以利用已知的反應焓變計算未知的反應焓變。
(1)同素異形體反應焓變的求算及穩定性的比較。
(2)根據一定量的物質參加反應放出的熱量(或根據已知的熱化學方程式),進行有關反應焓變的計算或大小比較。
利用蓋斯定律進行問題分析時,常採用熱化學方程式加合法和虛擬途徑法。
(1)加合法:根據需要將熱化學方程式進行代數轉換,然後相加,得出所需要的熱化學方程式。轉換時應注意各物質的係數與ΔH的數值同等倍數的改變,ΔH的符號也作相應的改變。
(2)虛擬途徑法:先根據題意虛擬轉化過程,然後根據蓋斯定律列式求解,即可求得待求的反應熱。
反應焓變的測定
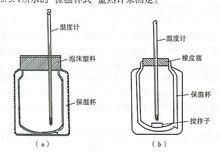 反應焓變的測定裝置
反應焓變的測定裝置 以測定固體物質鋅粉和硫酸銅溶液中的銅離子發生置換反應的化學反應焓變:Zn(s)+CuSO(aq) = ZnSO(aq)+Cu(s) △H(298.15K)=-217kJ·mol。
這個熱化學方程式表示:在標準狀態,298.15K時,發生了一個單位的反應,即1mol的Zn與1mol的CuSO發生置換反應生成1mol的ZnSO和1mol的Cu,此時的化學反應的焓變△H(298.15K)稱為298.15K時的標準摩爾焓變,其單位為kJ/mol。
測定化學反應熱效應的儀器稱為量熱計。對於一般溶液反應的摩爾焓變,可用圖示的“保溫杯式”量熱計來測定。
在實驗中,若忽略量熱計的熱容,則可根據已知溶液的比熱容、溶液的密度、濃度、實驗中所取溶液的體積和反應過程中(反應前和反應後)溶液的溫度變化,求得上述化學反應的摩爾焓變。其計算公式如下:
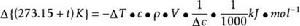 反應焓變
反應焓變 △H——在實驗溫度時的化學反應摩爾焓變(kJ/mol);
△T——反應前後溶液溫度的變化(K);
c——CuSO溶液的比熱容(J·g ·K );
ρ——CuSO溶液的密度(g·dm );
V——CuSO溶液的體積(cm)。