定義
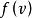 最概然速率
最概然速率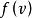 最概然速率
最概然速率 最概然速率
最概然速率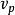 最概然速率
最概然速率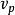 最概然速率
最概然速率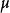 最概然速率
最概然速率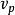 最概然速率
最概然速率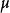 最概然速率
最概然速率速率分布曲線有一個高峰(如圖1),即速率分布函式 有一個極大值。與 極大值對應的速率叫做 最概然速率,通常用 表示。它的物理意義是,如果把整個速率範圍(從0到∞)劃分成許多相等的小區間,則分布在 所在區間內的分子數的比率最大。 的大小由氣體的溫度T和摩爾質量 決定。由麥氏速率分布律可以求出 與T和 的關係為
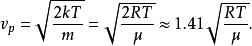 最概然速率
最概然速率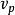 最概然速率
最概然速率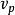 最概然速率
最概然速率這說明,溫度越高, 越大,速率分布曲線的高峰向速率大的一方移動;氣體的摩爾質量越大, 越小,速率分布曲線的高峰向速率小的一方移動。
相關概念
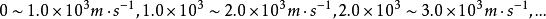 最概然速率
最概然速率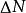 最概然速率
最概然速率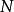 最概然速率
最概然速率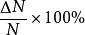 最概然速率
最概然速率在氣體內部,所有的分子都以不同的速率運動著,有的分子速率大,有的分子速率小,而且由於相互碰撞,每個分子的速率都在不斷地改變。所以,如果在某一特定的時刻去觀察某一特定的分子,那么它具有多大的速率完全是偶然的。然而,在一定的條件下,大量分子的速率分布卻遵從著一定的統計規律。表1中列出的是用實驗方法測量在某一溫度下銀蒸氣分子(銀原子)速率分布所得到的數據。實驗時把鍍銀層劃分成許多連續的狹條形區域並測出每一區域中銀的相對沉積量,因而結果就得到在不同速率區間(如 )內分子數 所占總分子數 的百分比 。
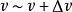 最概然速率 最概然速率 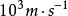 最概然速率 最概然速率 | 0-1 | 1-2 | 2-3 | 3-4 | 4-5 | 5-6 | 6-7 | |||
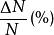 最概然速率 最概然速率 | 0.5 | 3 | 7 | 11 | 15 | 15.5 | 14 | |||
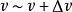 最概然速率 最概然速率 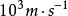 最概然速率 最概然速率 | 7-8 | 8-9 | 9 -10 | 10- 11 | 11- 12 | 12- 13 | 13以上 | |||
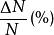 最概然速率 最概然速率 | 11.5 | 9 | 7 | 3 | 2 | 1 | 0.5 | |||
 最概然速率
最概然速率 最概然速率
最概然速率 最概然速率
最概然速率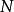 最概然速率
最概然速率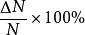 最概然速率
最概然速率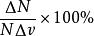 最概然速率
最概然速率顯然,我們可以把上表所列的數據畫成圖1(像在計畫統計部門常見到的一些掛圖),把銀分子的速率分布情況更形象、直觀地表示出來。在圖1中橫坐標是速率v(以 為單位),每個狹長矩形的底邊對應於一個速率區間 ,每個矩形的面積表示分布在該區間內的分子數 占總分子數 的百分比 ,因而縱坐標則表示分布在單位速率區間內的分子數占總分子數的百分比 。
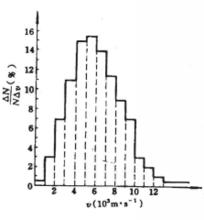 圖1
圖1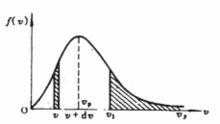 圖2
圖2 最概然速率
最概然速率不難想像,如果在實驗時把鍍銀狹條分割得更細,即把速率區間 劃分得更小,則在圖1中所得到的一些狹長矩形將變得更窄。在極限情形下,圖1中各矩形上頂邊的連線將變成如圖2所示的光滑曲線。顯然,這樣的圖線能更精確地反映氣體分子的速率分布情況。
實際上,在測定氣體分子速率的實驗獲得成功之前英國物理學家麥克斯韋(1831一1879)等人已從理論上確定了平衡態下氣體分子按速率分布的統計規律。這個規律叫做 麥克斯韋速 率分布律,或簡稱 麥氏速率分布律。由麥氏速率分布律所確定的氣體分子的速率分布情況與實驗結果能很好地吻合,麥氏速率分布律的解析表達式比較複雜,在這裡不作介紹。由解析表達式可以畫出精確反映氣體分子速率分布的圖線,如圖2。這種圖線叫做 麥氏速率分布曲線。
速率分布函式
 最概然速率
最概然速率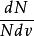 最概然速率
最概然速率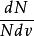 最概然速率
最概然速率 最概然速率
最概然速率在圖2中,與不同速率 對應的縱坐標 有不同的值。也就是說,縱坐標 是 的函式,因此可以令
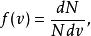 最概然速率
最概然速率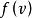 最概然速率
最概然速率叫做 速率分布函式。
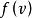 最概然速率
最概然速率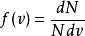 最概然速率
最概然速率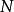 最概然速率
最概然速率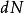 最概然速率
最概然速率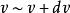 最概然速率
最概然速率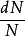 最概然速率
最概然速率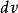 最概然速率
最概然速率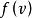 最概然速率
最概然速率在 和定義式 中, 是總分子數, 是分布在某一速率間隔 曲內的分子數, 是分布在這一速率間隔內的分子數占總分子數的比率, 是速率間隔的大小,所以 表示分布在速率v附近單位速率間隔內分子數占總分子數的比率。這就是速率分布函式的物理意義。速率分布函式是一個普遍的概念。氣體分子在不同的條件下有不同的速率分布函式,麥氏速率分布律則在於給出了氣體分子在平衡態下的速率分布函式。
麥氏速率分布曲線的特徵
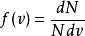 最概然速率
最概然速率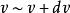 最概然速率
最概然速率由圖1可見,速率分布曲線從坐標原點出發,經過一極大值後,隨速率的增大而趨近於橫坐標軸。這說明氣體分子的速率可以取0到∞之間的一切數值;速率很大和很小的分子所占的比率都很小,而具有中等速率的分子所占的比率卻很大。由速率分布函式的定義式 可知,圖1中任一速率間隔 內曲線下的狹條面積等於
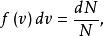 最概然速率
最概然速率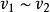 最概然速率
最概然速率它表示分布在這個速率間隔內的分子數占總分子數的比率。而任一有限區間 內曲線下的面積等於
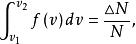 最概然速率
最概然速率表示分布在這個速率區間內分子數的比率。
現在進一步考慮速率分布曲線下的總面積等於多少。由以上討論可知,曲線下的總面積為
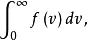 最概然速率
最概然速率 最概然速率
最概然速率它表示速率分布在0到 整個速率範圍r內的分子數占總分子數的比率,它顯然應等於1。即
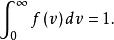 最概然速率
最概然速率這個結論是由速率分布函式的物理意義所決定的,它是速率分布函式所必須滿足的條件。

