簡介
電解分析法electrolyticanalysis 建立在電解過程基礎上的電化學分析法。又稱電重量分析法。此法中被測定的金屬離子以一定組成的金屬狀態在陰極析出或以一定組成的氧化物形態在陽極析出,從析出的重量可求出溶液中金屬離子的含量,所以此法也稱為電重量分析法,是一種古老的分析技術。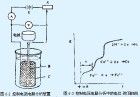 電解分析法
電解分析法工作原理
電解是在電解池中進行的,外加電源的正極和負極分別與電解池的陽、陰極相連。在電解過程中,在陽極上發生氧化反應,在陰極上發生還原反應。當實際施加於兩極的電壓大於理論分解電壓、超電壓和電解迴路的電壓降之和,就能使電解過程持續穩定地進行,被測金屬離子以一定組成的金屬狀態在陰極析出,或以一定組成的氧化物形態在陽極析出。電重量分析法隨電解過程的不同,分為恆電流電解分析法、控制陰極電位電解分析法、內電解分析法和汞陰極電解分析法。恆電流電解分析法
通過調節外加電壓使電解電流在電解過程中保持恆定。常見的裝置見圖1。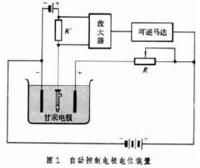 圖1 電解分析法
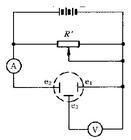
圖1 電解分析法電解過程中產生電流的大小依賴於電極反應的速度,隨著電解時間延長,溶液中電活性物質濃度降低,它傳輸到電極表面的速度減慢,使通過電解池的電流減小。為了使電流保持一定的大小,不斷增大外加電壓。當外加電壓達到第二個電活性物質的析出電位時,則第二個電活性物質也開始在電極上析出,造成相互干擾。此法的優點是電解時間短,缺點是選擇性差,只能使析出電位在氫以上與以下的金屬得到定量分離,適用於溶液中只有一種較氫更易還原析出的金屬離子的測定。 控制陰極電位電解分析法在電解過程中將陰極電位控制在一預定值,使得只有一種離子在此電位下還原析出。圖2為自動控制電極電位裝置。由負極和甘汞電極組成一個電池,另外用一輔助電壓與該電池對接(負極對負極)。如果要將負極電位控制在-0.35V(對甘汞電極而言),就要將輔助電極調到0.35V。如果負極的電位比-0.35V更負,就有電流通過R′,R′上的電壓降經過放大後可使馬達轉動,使R′增大,負極電位比-0.35V正。如果R′上電子的流向相反,則可逆馬達朝反方向轉動,使R′變小,直到負極電位回復到-0.35V為止。此法的優點是選擇性高,缺點是分析時間較長。
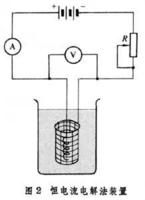 圖2 電解分析法
圖2 電解分析法內電解分析法
外加電壓而藉助於兩個電極本身組成的原電池的電動勢來進行電解,通過置換反應使被測金屬離子在陰極上定量析出。它又稱為自發電解法。此法的優點是選擇性好。缺點是完全電解所需時間長。汞陰極電解分析法
以汞或汞齊化鉑為陰極。以鉑為陽極。由於汞有毒,易揮發,很少作為一種重量法直接用於元素測定,但可作為一種進行分離的有效手段。電解分析方法
控制電位的電解分析法此法根據下列原理控制電極電位,電解方程為:V-iR=V′=(E+-E-)+ir式中V為電源電壓;i為電流,R為電解池外線路的電阻;V′為加於兩電極的外加電壓;E+和E-為正極和負極的電位;r為電解池的內阻。
由上式可得:-E-=V-i(R+r)-E+
當V與E+的值相對穩定時,i愈小,則E-的值愈負。電解開始時,電流很大,以後逐漸減小,為了保持E-為定值,必須隨時調節電阻R。
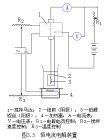 控制電流分析法
控制電流分析法圖1為自動控制電極電位裝置。令負極和甘汞電極組成一個電池,另外用一個輔助電壓與該電池對接(負極對負極)。如果要把負極的電位控制在-0.35伏(對甘汞電極而言),就要將輔助電極調到0.35伏。如果負極的電位比-0.35伏更負,就有電流通過電阻R′,R′上的電壓降經過放大後可使可逆馬達轉動,使R增大,使負極的電位比-0.35伏正。如果R′上電子的流向相反,則可逆馬達朝相反方向轉動,使R變小,直到負極電位回復到-0.35伏為止。
控制電位電解法可用來分離並測定銀(與銅分離)、銅(與鉍、鉛、錫、鎳分離)、鉍(與鉛、錫分離)、鎘(與鋅分離)等。此法的優點是選擇性高,缺點是分析時間較長。用一到三個串聯的蓄電池為電源,通過可變電阻R與兩個電極相連。析出金屬的電極常用網狀鉑電極,另一個螺鏇形鉑電極兼作攪拌器。通過電解池的電流約為3~5安培,在電解過程中,使加到兩極上的電壓不斷增大,並使電流保持不衰,雖然電解池的電流不是恆定的,但仍稱恆電流電解法。電解分析法的優點是測定速度高。恆電流電解法的準確度在很大程度上決定於澱積物的性質,它必須堅固地附著在電極上,以防止在洗滌、烘乾和稱重時脫落。電解時電極表面的電流密度愈小,澱積物的性質愈佳。如果電流密度過高,澱積速度過快,容易使澱積物不純。電極上析出氫氣,容易使澱積物成海綿狀,且易從電極上脫落。為了得到良好的澱積物,必須使用不太大的電流,充分攪拌溶液和使用具有絡合能力的電解液。
 電解分析法
電解分析法此法的缺點是選擇性差。既不能用來分離Cu2+和Ag+,又不能分離Cd2+和Zn2+,只能用於分離電位序中H+以上的金屬和H+以下的金屬(見氧化還原電勢)。
