發現過程
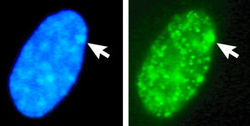 女性人類的纖維母細胞細胞核,左圖是DAPI染色圖;右圖是同一細胞核針對macroH2A組織蛋白進行染色所得圖像,可見其中macroH2A的分布情形。箭頭所指為X染色體,也就是巴爾小體所在位置。
女性人類的纖維母細胞細胞核,左圖是DAPI染色圖;右圖是同一細胞核針對macroH2A組織蛋白進行染色所得圖像,可見其中macroH2A的分布情形。箭頭所指為X染色體,也就是巴爾小體所在位置。1948年加拿大學者穆雷·巴爾和研究生尤爾特·伯特倫(EwartGeorgeBertram)研究有關疲勞對大腦的影響,觀察貓腦組織為養本,以福爾根試劑(Feulgenstain)將細胞核內的DNA染色。在觀察一些母貓神經元時,他意外發現在核膜內緣有一小團染色極深的鼓槌狀物質(公貓則沒有這樣的現象),由於神經元細胞當時不是處在細胞分裂狀態,DNA應是散落成染色絲,不該結成團狀構造。巴爾在觀察了其他動物的相關玻片標本後,歸納出一個結論:這些DNA團塊是存在雌性哺乳類細胞內的明顯差異。
次年,巴爾與伯特倫聯合出版了一篇論文,發表他所發現的奇異現象,當時他將發現的小團鼓槌狀物質稱為“性染色質”(Sexchromatin),也就是後人所謂的“巴爾小體
”。
 上圖為共聚焦雷射掃描顯微鏡下的女性的神經細胞,X染色質經由螢光原位雜交標記,其中Xa為有用的X染色體,Xi為去活化的X染色體;下圖為DAPI染色的相同神經細胞,其中箭頭所指即為巴爾小體
上圖為共聚焦雷射掃描顯微鏡下的女性的神經細胞,X染色質經由螢光原位雜交標記,其中Xa為有用的X染色體,Xi為去活化的X染色體;下圖為DAPI染色的相同神經細胞,其中箭頭所指即為巴爾小體1955年,巴爾和解剖學家穆爾(K.L.Moore)觀察口腔黏膜發現,女性口腔上皮細胞核膜內緣有同樣的小體緊貼在核膜上,而男性卻沒有。這進一步證明了這個染色較深的小體和性別有關。人們把這個染色較深的小體稱為性染色質,又稱巴氏小體。
1960年,洛杉磯希望之城癌症研究中心的科學家大野乾經過徹底研究雌鼠的X染色體後宣布,巴爾小體其實就是X染色體,隔年英國的遺傳學家瑪莉·里昂發表了一篇論文,以精簡的文字將當時已知的各種現象串連起來,解釋巴爾小體
的存在,及它如何以前所未知的方式對哺乳動物造成影響。
里昂假說
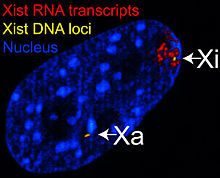 此為共聚焦雷射掃描顯微鏡下的RNA-DNA螢光原位雜交實驗,其中黃色為Xist的DNA,紅色為Xist的RNA,圖中顯示只有一個X染色質(右上角的那個)有被XistRNA包覆,形成巴爾小體(Xi)
此為共聚焦雷射掃描顯微鏡下的RNA-DNA螢光原位雜交實驗,其中黃色為Xist的DNA,紅色為Xist的RNA,圖中顯示只有一個X染色質(右上角的那個)有被XistRNA包覆,形成巴爾小體(Xi)瑪莉·里昂提出,雄鼠和基因型為“XO”的異常雌鼠只有一條X染色體,細胞就能正常運作,因此正常雌鼠也應該只需要一條X染色體就能運作,不用兩個活化的X染色體。其次,巴爾小體在很早期的胚胎階段就已出現。最後,里昂提出她所觀察到小鼠毛色的特殊模式:已知控制毛色的基因位於X染色體,毛色的表現依循性聯遺傳,異型合子的雌鼠會出現特有的斑駁毛色,也就是由兩種顏色的毛皮組成,隨機分布而成斑塊狀。
里昂解釋,雌鼠胚胎髮育時,細胞會隨機關閉一條X染色體,並將其聚縮成巴爾小體(這條染色體被稱為Xi),從此之後,由這些細胞複製、分化來的子細胞,遺傳到的兩條X染色體中,都有一條是不活化的巴爾小體,只由另一條正常的X染色體(這條染色體被稱為Xa)表現基因,影響細胞運作。結果,雌鼠體內就會含有兩大群不同的細胞,用不同條X染色體影響各種性狀,因為兩個X染色體中哪一個將形成巴爾小體的選擇是隨機和獨立地發生在胚胎的每一個細胞,雌性哺乳動物(包括人在內)其實是兩種細胞的“鑲嵌體”(mosaic)。
花貓的毛色
 三色貓的斑駁毛色是巴爾氏體的表現,“黑色皮毛”與“橙色皮毛”的等位基因位於不同的X染色體上。由於去活化的對象是隨機選擇,因此不同部位,會依保留活性之染色體的不同,而有不同的毛色。
三色貓的斑駁毛色是巴爾氏體的表現,“黑色皮毛”與“橙色皮毛”的等位基因位於不同的X染色體上。由於去活化的對象是隨機選擇,因此不同部位,會依保留活性之染色體的不同,而有不同的毛色。里昂提出,“鑲嵌體”的現象不只發生在雌鼠身上,因為雌性獨有的斑塊毛色現象也出現在其他哺乳動物,里昂以花貓為例,經研究證明她的舉例是正確的。
控制貓毛呈橘色或黑色的基因在X染色體上,而控制白色的基因則在體染色體上。正常的“XY”公貓因為只有一個X染色體,只帶有黑色或橘色基因,因此外表只可能是全黑或全橘,不會呈現花貓斑塊的特徵;但擁有“XX”染色體的母貓卻可能同時帶有黑色和橘色的基因,經過胚胎初期隨機的X染色體去活化作用,其毛皮由關閉黑色基因和關閉橘色基因這兩群細胞組成,換句話說,每個細胞選擇的Xa不同,造成花貓呈現花斑狀毛色。
結構與機制
巴爾小體依附在細胞核邊緣的核膜內側,雖然此染色體上的小部份區域能保持著活躍的狀態,但大多數的基因都是不會表現的。X染色體去活化發生後,形成巴爾小體的那條X染色體通常稱為Xi,其大部分基因將不會被表現;另一條基因能得到充分表現的X染色體則稱為Xa。X染色體失活從“X失活中心”(Xic)開始向兩側擴張,負責失活現象的基因則是其中的Xist。
X失活中心
失活的X染色體(Xi)由其上的某個點開始往兩頭產生皺縮,直到染色體的末端,這個開始產生皺縮的點被稱為“X失活中心”(Xinactivationcenter,Xic),其上有Xist(X-inactivespecifictranscript,意為失活X染色體特定轉錄)和Tsix(Xist的反義序列)兩段主要基因,Xist與Tsix都會轉錄成RNA分子,但不會進一步轉譯成蛋白質。Xist是執行X染色體去活化的基因,其轉錄出的RNA會把Xi包圍,這個動作稱為基因沉默(genesilencing),能使Xi皺縮成巴爾小體,其上多數基因都無法表現。
Tsix基因是Xist的反義序列(AntisenseRNA),其編碼和Xist正好相反,它們產生的RNA有互補作用,所以Tsix對Xist有抑制作用,為其負向調節因子。
在X染色體去活化發生之前,兩個X染色體都會些微表現Xist和Tsix兩個基因,當去活化開始時,Xa將停止表現Xist基因,並持續表現Tsix基因達數日之久;Xi則加強表現Xist,並停止表現Tsix。
無論細胞中有幾個X染色體(即包括XXY、X0與XX雜合體、XXXY等特殊情況),除了一個X成為Xa之外,其他X染色體上的Xist基因都能正確啟動。且Xist不只能作用於X染色體,若將Xist剪接到其他體染色體上,該條染色體也會失去活性。
研究人員分析Xist基因的細節,已能將Xist分成幾個不同部分,甚至證明了特定區域與計算X染色體數量有關,特定區域與該選擇哪一條X染色體作為Xi有關,其他區域則與失活的過程有關。Xist轉錄產生的RNA上有一段被稱為“A區域”(Aregion)的片段,該片段有九個重複序列。最近的發現說明A區域由兩段長長的莖環(Stem-loop)組成,每段莖環上有四個重複序列。A區域的具體功能目前仍不清楚,但已知它和蛋白質的結合有關。
阻礙因子
關於生物如何避免讓兩段X染色體都失活,目前的假說認為體染色體上有某個基因可以製造“阻礙因子”(blockingfactor),阻礙因子可與X染色體結合,避免其被去活化,而其他未結合阻礙因子的X染色體則不受保護。因為含多條X染色體而體染色體正常的細胞只會有一個Xa,且體染色體為兩倍的細胞會有兩個Xa,可使這個假設得到證實。
偽體染色體區
在失活的Xi染色體中,仍有少量基因能夠表現,即偽體染色體區(pseudoautosomalregion),其上的基因同時存在於Y染色體,因此這些基因無論在男性或女性體內都表現兩倍的劑量,不像X染色體的其他區域基因是單獨存在。偽體染色體區在人類只占X染色體的一小部分,在老鼠細胞中則占X染色體高達25%,其上只有低量的Xist表現,所以其基因可以得到充分表現。
巴爾小體中的偽體染色體區基因仍可表現,解釋了有多重X染色體(如XXY、XXXY、XXX等)的細胞異常的原因。
在高等哺乳類細胞中,除了偽體染色體區之外,還有個別基因可以不同方式調節自己的作用,逃開失活過程。
失活的時期
發生X染色體去活化的時間很早,在二細胞至四細胞時期(two-cellorfour-cellstageembryos)就已發生,其中外細胞團的細胞(extraembryonictissue,未來將成為胎盤)中的Xi將繼續保持失活狀態;內細胞團的細胞(innercellmass,未來將成為胚胎)中的Xi則會復原,之後再失去活性。以老鼠為例,其第一次X染色體去活化受基因銘印影響,全部使父系X染色體成為Xi,母系X染色體成為Xa,第二次去活化則是隨機選擇。這種機制使胎盤的X染色體全為母系,可能可以避免其受母體細胞排斥(但由於控制排斥的基因多不在X染色體上,關閉胎盤的父系X染色體可能無法避免移植排斥,目前這種說法未有定論)。
X染色體劑量問題
正常男性只有一條X染色體,女性卻有兩條,而染色體的劑量過多或不足是常會造成遺傳疾病的,例如人類的第21號染色體如果多了一條就會造成唐氏症,但X染色體既能單獨出現在正常人體內(如男性),又能成對出現(如女性)。早在1930年代,生物學家就已發現這種染色體含量不均等的問題,並納悶為何女性不會因為X染色體劑量過多而發生問題。
里昂的理論可完美解釋這個問題,為了避免基因過量,女性胚胎會隨機讓每個細胞的一條X染色體失去活性,變成巴爾小體,所以女性的每個細胞都只有一個有作用的X染色體,不會產生過量的問題。
其他動物可能有別的方法避免X染色體劑量不均等,例如線蟲不會進行X染色體去活化,而是把雌性兩條X染色體的活性都減半;果蠅則是雌蠅的兩條X染色體都有正常作用,但雄蠅的單一X染色體會發揮兩倍的活性。
另外,由於不同於體染色體,無論男性或女性都只有一條有用的X染色體,所以X染色體上的基因的活性都需要加倍,以達到正常需求。這也使體染色體和X染色體間產生阻隔,在演化的過程中,基因有時會移位至別的染色體,但鮮少從體染色體移至X染色體,或從X染色體移至體染色體,因為活性的差異,體染色體的基因若到了X染色體,則其活性只有周圍基因的一半;而X染色體的基因若到了體染色體,活性則會是周圍基因的兩倍,顯得太活躍。
例外情形
雖然雌性哺乳類身上的細胞幾乎都有X染色體去活化的機制,但仍有不少例外情形。
卵子
女性的卵子細胞會將Xist基因關閉,使已經形成的巴爾小體再次展開,轉變回原始的狀態。這種機制的目的是母體不能把巴爾小體傳給子代,因為卵子無從得知子代將形成男性或女性,若子代是男性,又移傳到巴爾小體,就會危及男孩的性命,所以每個女性必須重新啟動失活過程。
但由於帶有兩個功能齊全的X染色體將造成劑量過多的問題,而卵子在形成後將在女性體記憶體活四十年以上,在這段期間內,卵子如何避免X染色體劑量過多造成的危險情況,目前仍是個謎。
有袋類
有別於胎盤類,有袋類動物如袋鼠在X染色體去活化的過程中,不會隨機選擇,而是一律關閉父系的X染色體,所以雌袋鼠除了卵子外都不使用父本基因,因此它們不會形成鑲嵌體。
逃離去活化
在高等哺乳類細胞中,X染色體去活化的過程更加複雜,除了偽體染色體區之外,還有些個別基因可以逃離去活化的過程。目前這種機制仍不清楚,但推測可能與長段非編碼RNA(Longnon-codingRNA)的表達有關。
影響
巴爾小體的產生造成女性成為鑲嵌體,對女性的許多疾病和基因表現都有顯著的影響。許多費解的現象都能由巴爾小體獲得解釋,但大部分理論都還有缺陷,需要進一部的證據。
同卵雙胞胎
同卵雙胞胎姊妹間雖然基因大致相同,卻可能因為X染色體去活化而產生差異,如果一個女性身上的細胞剛好使用較多的母系X染色體,而她的雙胞胎姊妹則偏好使用較多的父系X染色體,則她們的性狀(甚至包括罹患遺傳疾病與否)都會有所差異。由於女性有約5%的基因存在X染色體上,因此高達5%的基因可能造成同卵雙胞胎姊妹的差異(另外無論性別,受精卵分裂成兩個個體後,還會發生一些小變化,造成雙胞胎之間的差異)。
同卵雙胞胎姊妹常偏好使用不同的X染色體,關於此現象的解釋有個頗具爭議的理論,即女性胚胎細胞在選定失活的X染色體後,會主動將自己分為兩大群採用不同Xa的細胞,這兩群細胞可能主動排斥而造成胚胎分裂,形成雙胞胎,有人還進一步延伸表示。這個理論還存在許多瑕疵,如不能解釋同卵雙胞胎兄弟的形成,但已經引起相當的討論。
性聯遺傳疾病
女性若只有一個帶有性聯疾病基因的X染色體,並不會發病,因為另一個X染色體上正常的基因可彌補此缺陷。以血友病為例,致病原因是第八凝血因子缺乏,而第八凝血因子是由肝臟製造,控制其生產的基因位在X染色體上,男性因為只有一個X染色體,若基因受損,肝臟即完全無法製造第八引子而致病;而女性若有一個X染色體帶有受損基因,則在X染色體去活化的結果下,將有一部分的肝臟細胞有製造第八因子的能力,另一部分則沒有,而有製造第八因子能力的那一部分肝臟細胞即能維持身體的機能,因此有一個X染色體基因受損的女性不會得到血友病。
上述是不同細胞可替代彼此功能的例子,但對於無汗症(Hypohidroticectodermaldysplasia)而言,該病將導致皮膚缺乏汗腺,因此帶有一個缺陷基因的女性將會有一部分皮膚有汗腺,另一部分沒有,形成顯著的“鑲嵌模式”。
自體免疫疾病
自體免疫疾病的女性患者多於男性患者,且XXY的男性明顯多於正常男性,對此有人主張造成自體免疫的疾病可能和巴爾小體有關。機制是若胸線中的細胞在X染色體去活化後偏向使用某一個X染色體,可能導致產生的部分淋巴球只認得活化的X染色體和胸線細胞相同的細胞,而誤把失活方向為另一個X染色體的細胞當成外來物質,加以攻擊。
女性和XXY的男性均有巴爾小體,而自體免疫疾病的女性患者高達男性的四倍,且XXY的男性比正常男性容易得到自體免疫疾病,以及某些女性的自體免疫疾病呈現鑲嵌模式等證據支持這個理論,且已有實驗證明兩種自體免疫疾病:類風濕性關節炎及橋本氏甲狀腺炎(Hashimoto'sthyroiditis)的產生均和X染色體去活化有關。但仍有其他理論解釋自體免疫疾病的成因,如激素的影響或胎兒細胞的殘留。
套用
自1968年墨西哥奧運會起,奧運首次開始檢測女性運動員的性別,以有巴爾小體與否做為判斷女性的辨識標準,這是區分人類性別的一種簡單方式。1992年巴塞隆納夏季奧運會之後,國際奧委會改以用聚合酶鏈鎖反應(PCR)的方法檢測Y染色體上的SRY基因。1999年後國際奧委會停止進行性別檢測,而只對特定有爭議的運動員進行個別檢測,其中原因包括其衍伸的性別歧視問題(因為只有女性需要做性別檢測),以及生物性別不一定等於基因性別等,即應以運動員體內雄性激素表現量來判定他屬於男性或女性的體能,而非染色體。2008年的北京奧運會首次成立“性別鑑定實驗中心”,被懷疑性別的女運動員將到此接受篩檢,檢測項目包括臨床、性激素、基因、染色體等。
比起刻意隱瞞性別者,比較多的情況是性別處於模糊地帶或自己不清楚自己的性別,例如其中有的是睪丸女性化綜合症(testicularfeminizationsyndrome,FS),該疾病會讓XY的男性發育成女性的外表。
