概述
基因飛彈,洛杉磯加大(UCLA)華裔研究團隊的研究成果登上權威期刊“科學”(Science)雜誌,教授周正洪、吳若萍,和博士後研究員劉紅榮,發展以病毒攜帶改良基因當載體,追蹤或攻擊癌細胞的標靶治療方法,為癌症病患在傳統手術和放射線治療外開創新生機。
研究項目
1、專長癌症治療的吳若萍,是洛杉磯加大分子醫學所(Molecular Medicine)教授,在病毒學和基因改良方面經驗豐富,癌細胞會擴散轉移,使癌症治療非常困難。以手術切除患部或用放射線治療後,病患仍可能有20-30%的復發率。她和微生物、免疫、分子基因學教授周正洪的想法是,用病毒來辨識癌細胞,先將腺病毒進行基因改造,讓病毒只有在遇到癌細胞時才產生作用,就可透過將病毒打入癌症患部或血液的方式,追蹤癌細胞擴散,或殲滅身體中的癌細胞。
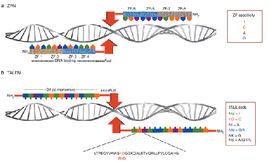
2、周正洪說,他的團隊利用冷凍電子顯微鏡(cryo-electron microsocopy)拍攝吳若萍提供的樣本,在3萬1815張病毒圖片中挑出較好的樣本,以三維重建技術(3-D reconstruction)顯示病毒的原子量級結構,讓基因改良學者可了解病毒結構,更有效的改變病毒基因。
研究目標
1、研究目標是建立更有效的基因治療,來診斷和治療癌症。
2、研究採用的腺病毒已被發現50年,為學界熟知,套用也最廣泛。目前有部分基因改良治療已進入臨床實驗階段,但過去只能掌握病毒分子形象,這次的病毒原子形象圖可讓學者更容易改變病毒基因結構。
3、病毒就像車子,車上的貨物是基因,但車輛需要司機控制行駛方向,如何控制車開向何處,就是靠基因改良技術。
4、研究成果發表於2010年8月27日出版的“科學”雜誌。有了腺病毒原子量級的影像,可讓病毒基因的修改和試驗更有效率,為癌症治療帶來突破,一兩年內應該就可進入下一代的基因改良。
生物結構
1、CryoEM使高解析度的生物結構重建成為可能,因為水中的樣本可直接成像。x -射線結晶照相技術與之相反(傳統的原子分辨生物結構模型技術)。研究者需要複製樣品的晶體結構,然後用衍射技術獲得晶體結構。該技術有限制性,因為製作所有蛋白質的晶體機構很困難,用於x射線的結晶樣品需要很純和均一,大的複雜的結晶不能進行高解析度衍射,這些限制導致使用x -射線結晶照相不能得到腺病毒表面關鍵領域高解析度的生物結構重建。納米技術其中一個重要的難點就是不能實實在在的看到研究對象的作用方式。例如病毒小於光波長度,標準的光學顯微鏡看不見其生物結構,利用其他成像技術也很難捕捉到它。而在這篇文章中,研究人員cryoEM技術不僅能看見病毒,並且可對病毒進行修飾使其能夠向病變部位遞送藥物。
2、研究人員揭示了腺病毒準確的原子分辨的三維結構和其蛋白質網路的相互作用。該發現為世界各地試圖修飾腺病毒用於疫苗和癌症基因治療的研究者提供了關鍵的結構信息。修飾病毒用於基因治療,研究者需要去除致病的DNA,用藥物替代,還要利用病毒的外殼。腺病毒經過數百萬年的進化,非常適合用作傳遞媒介。除此之外,周正洪研究組還與中科院武漢病毒所水生病毒及結構與功能研究學科組合作,發現了無包被病毒在入侵細胞的過程中膜穿透蛋白的新機制,這一研究為解析此類病毒入侵細胞的特點,以及相關病毒性疾病的防治提供了重要信息。這一研究成果公布在Cell的封面上。無包膜病毒為了能進入細胞,需要經由一個休眠到初免的過程,但是相對與包被病毒,比如流感病毒,科學家們對於無包膜病毒的膜侵入機制了解的並不多。
研究進展
 基因飛彈
基因飛彈1、在這項合作研究中,研究人員以無包膜的雙鏈RNA病毒——草魚呼腸孤病毒(Grass Carp Reovirus, GCRV)為研究模型,採用單顆粒低溫冷凍電子顯微技術構建了GCRV感染性亞病毒顆粒(ISVP)高解析度的原子模型,此模型包括膜穿透蛋白VP5和三種核心蛋白的6種構象異構體近5000個蛋白殘基,突破性地揭示了病毒入侵過程中膜穿透蛋白由靜息(dormant)狀態到起動(Priming)狀態轉換的動態過程。這一創新性發現為進一步研究病毒入侵機制以及相關病毒性疾病的防治提供了重要的依據。
2、一直以來,科學家們對於包膜病毒細胞進入的膜融合機制的研究已經十分深入,但是對於無包膜病毒的細胞入侵機制卻知之甚少。隸屬於武漢病毒所病毒學國家重點實驗室的水生病毒及結構與功能學科組主要的研究方向是以水生生物病毒-草魚呼腸孤病毒(Grass Carp Reovirus,GCRV)為研究模型,進行包括人類、哺乳動物、水生動物、植物、昆蟲的dsRNA病毒的基因組與衣殼蛋白的結構與功能比較研究,探討dsRNA病毒內源性轉錄複製機理以及病毒外衣殼蛋白在侵染過程中與宿主細胞的相互作用。
3、相關研究工作正進一步推進與展開。通過構建突變的外衣殼蛋白基因重組克隆,在體外表達帶有功能位點突變的外衣殼蛋白及進行與核衣殼的體外包裝,以期對無包膜病毒進入細胞的分子機制獲得更深入的了解,最終達到阻斷病毒感染的目的。