簡介
 土壤膠體
土壤膠體種類
 土壤膠體
土壤膠體Ⅰ無機膠體:無機膠體在數量上遠比有機膠體要多,主要是土壤粘粒,它包括Fe、Al、Si等含水氧化物類粘土礦物以及層狀矽酸鹽類粘土礦物。
1、Fe、Al、Si等含水氧化物
含水氧化矽:多寫成SiO2·H2O,也可寫成偏矽酸H2SiO3,SiO2·H2O發生電離時能解離出H+而使膠體帶負電荷。
含水氧化Fe、Al:多寫成Fe2O3·nH2O、Al2O3·nH2O,也可用Fe(OH)3、Al(OH)3的形式來表示,它是矽酸鹽礦物徹底風化的產物,在風化程度高的土壤上這類礦物較多。
這類礦物屬兩性膠體,它的帶電情況主要取決於土壤的酸鹼反應,酸性條件(pH<5)帶正電荷,鹼性條件下帶負電荷。
2、層狀矽酸鹽類礦物
層狀矽酸鹽類礦物,從外部形態上看是極細微的結晶顆粒,從內部構造上看,都是由兩種基本結構單位矽氧四面體和鋁氧八面體所構成,並且都含有結晶水只是化學成分和水化程度不同而已。
構造特徵:
a:基本結構單位:構成層狀矽酸鹽礦物的基本結構單位是矽氧四面體和鋁氧八面體。
矽氧四面體:由一個矽離子(Si4+)和四個氧離子(O2-)組成,其中三個氧離子(O2-)構成三角形為底,Si4+屬於這個三角形之上,三個氧離子(O2-)的中心底凹處,第四個O2+屬於頂部,恰好把Si2+蓋在下面,象這樣的構造體從外表面看有四個面,每個面有三個O2+組成,Si4+居於四個面的中心,我們稱為矽氧四面體。
鋁氧八面體:由一個鋁離子(Al3+)和六個氧離子O2-(或氫氧離子)組成,六個O2-排成上下兩層,每層三個O2-(或OH—)構成三角形,但上層的O2-和下層的O2-位置相互交錯,Al3+居於兩層之間的中心孔穴內,這種結構體從外表上看有八個面,每個面都有三個O2+組成,Al3+居於八個面的中心,我們稱為鋁氧八面體。
b:單位晶片:從化學式上看,矽氧四面體(SiO4)4-和鋁氧八面體(AlO6)9-都還不是化合物,在形成矽酸鹽礦物之前,矽氧四面體和鋁氧八面體需要各自分別聚合,在平面上這種成單位晶片:矽氧四面體通過共用底部氧的方式在平面上連線成四面體片——矽片,矽片頂端的氧仍帶有負電荷。
鋁氧八面體通過共用兩端氧的方式在平面上連線成八面體片——鋁片,鋁片上下兩端的氧都帶有剩餘負電荷。
c:單位晶層:由於矽片n(SiO10)4-、鋁片n(Al4O12)12-都還帶有負電荷,不穩定,必需重疊化合以後,才能形成穩定的化合物,矽片和鋁片以不同的配合方式在垂直方向上重疊成單位晶層,根據形成單位晶層時矽片和鋁片的配合比例不同可形成2:1型、1:1型、2:1:1型的單位晶層。
1:1型單位晶層:由一層矽片和一層鋁片組成,矽片頂端的活性氧、鋁片底層的活性氧通過共用的方式連線在一起。
2:1型單位晶層:由兩層矽片夾一層鋁片組成,兩層矽片頂端的活性氧都朝向鋁片、鋁片兩端的氧分別與兩層矽片頂端的氧通過共用的方式連線在一起。
2:1:1型的單位晶層:在2:1型單位晶層的基礎上多了一個水鎂片和水鋁片。
d:層狀矽酸鹽礦物:單位晶層相互重疊後形成層狀矽酸鹽礦物,根據構成層狀矽酸鹽礦物的單位晶層類型的不同,可以把層狀矽酸鹽礦物分為以下幾類:
蒙脫石類礦物:2:1型膨脹性礦物,比如蒙脫石、蛭石、綠泥石
(1)2:1型晶層結構:單位晶層是由兩層矽片夾一層鋁片組成,矽片:鋁片=2:1,以蒙脫石最為典型。
(2)脹縮性大:這組礦物相鄰兩個晶層的層面都是Si—O面,晶層與晶層之間只能形成很小的分子引力,連線力弱,晶層間脹縮性大,晶層之間隨著水分的進入而膨脹,失去水分則收縮。
(3)電荷數量大:電荷數量大的原因是因為該組礦物同晶代換比較普遍。
同晶代換:組成礦物的中心離子被電性相同、大小相近的離子代替而晶格構造保持不變的現象。
①替代與被替代的離子大小必須相近,才能保證替代後晶形不發生改變。
比如Fe3+的半徑為0.064nm,八面體的中心離子Al3+的半徑為0.057nm,半徑相近可以發生替代而不會改變晶體形狀,而La(鑭)和Al是同族元素,性質更相近,但是La3+的半徑比Al3+大一倍以上,La3+不能代替Al3+。
②替代與被替代的離子電性必須相同,電價可以同價或不同價。
如果互換的兩個離子是同價的,互換後不僅晶形不變,而且仍保持電荷中性,如果互換的兩個離子是不同價的,就會使晶體帶正電荷或帶負電荷。
實際上矽酸鹽礦物中最常見的是晶體中心離子被低價陽離子取代:比如四面體中心離子Si4+被Al3+所取代,八面體中心離子Al3+被Mg2+所取代,所以粘土礦物是以帶負電荷為主的。
同晶置換是發生在晶體形成過程中,同晶置換產生的負電荷是存在於晶體內部,晶體一旦形成後,這種負電荷就被包蔽在晶體內部,它不會隨著外界環境(pH、電解質濃度)的改變而改變,所以同晶置換所產生的負電荷屬永久電荷。
同晶置換的結果,使蒙脫石類礦物帶有大量的負電荷,能吸附保存大量的陽離子,所以含蒙脫石類礦物高的土壤,其保肥性能良好。蒙脫石的同晶代換主要發生在鋁片中,以Mg2+代替Al3+,蛭石的同晶代換主要發生在矽片中,以Al3+代替Si4+。
(4)膠體特性突出:這一組粘土礦物,顆粒特別細,總表面積大,其可塑性、粘結性、粘著性、吸濕性都很顯著,對耕作不利。
高嶺石類礦物:也稱1:1型礦物,主要包括高嶺石、珍珠陶土、迪岩石及埃落石等。
(1)1:1型晶層結構:單位晶層是由一層矽片和一層鋁片組成,矽片:鋁片=1:1,所以這一組礦物又稱1:1型礦物,以高嶺石最為典型。
(2)非膨脹性:相鄰兩個晶層的層面,一個是矽片的Si—O面,一個是鋁片的Al—OH面,這樣在兩個晶層之間能形成鍵能較強的氫鍵,連線力強,晶層間不易膨脹。
(3)電荷數量少:這一組礦物矽片和鋁片中沒有或極少有同晶代換現象,其電荷的來源主要來源於兩個方面:一方面是晶體表面的斷鍵,另一方面是晶體表面的OH基在中性或鹼性條件下的解離,所以電荷數量少。含1:1型粘土礦物高的土壤其保肥性能差。
(4)膠體特性弱:雖然顆粒的大小在膠體範圍內,但顆粒直徑仍比其它矽酸鹽粘土礦物要大,而且外形大部分呈片狀,顆粒的總表面積相對較少,其可塑性、粘結性、粘著性、吸濕性小。
水雲母組:2:1型非膨脹性礦物,比如水雲母、伊利石。
(1)2:1型的晶層結構:晶層結構與蒙脫石相似,同樣是由兩層矽片夾一層鋁片組成,矽片:鋁片=2:1,以伊利石最為典型。
(2)非膨脹性:主要是伊利石的晶層與晶層之間吸附有K+,K+是半陷在晶層層面6個氧離子構成的六角形孔穴中,它同時受到相鄰兩個晶層負電荷的吸附,使相鄰兩個晶層產生了很強的鍵聯效果,連線力強,晶層不易膨脹。
(3)電荷數量大:同晶置換普遍,主要發生在矽片中,以Al3+→Si4+,鋁片中也有少量的Fe3+、Mg2+→Al3+,所以電荷數量大:但是因為部分的負電荷被K+中和,所以電荷數量介於高嶺石和蒙脫石之間。
(4)膠體特性:因顆粒大小,總表面積介於高嶺石和蒙脫石之間,所以可塑性、粘結性、粘著性、吸濕性也介於高嶺石和蒙脫石之間。
Ⅱ有機膠體
有機膠體主要指的是土壤中的腐殖質。
a.腐殖質顆粒很細小,具有巨大的比表面積。
每1克腐殖質的總表面積可達1000㎡,比表面積是極其巨大的。
b.帶有大量的負電荷
腐殖質組成中有很多的功能團,比如R—COOH、R—CH2—OH等這些功能團解離後能帶有大量的負電荷,腐殖質所帶負電荷的數量比粘土礦物要大得多,所以保存陽離子的能力也比粘土礦物要大得多。
另外腐殖質功能團中R—NH2的質子化,還能使腐殖質帶正電荷。
c.腐殖質是親水膠體,具有高度的親水性
腐殖質可以吸附大氣中的水汽分子,吸水最大量時可以達到自身重量的80—90%。
Ⅲ有機—無機複合膠體
在土壤中有機膠體一般很少單獨存在,絕大部分與無機膠體緊密結合在一起形成有機—無機複合膠體,有機膠體與無機膠體的連線方式是多種多樣的,但主要是通過二價、三價等多價陽離子(Ca2+、Mg2+、Fe3+、Al3+等)作為橋樑把腐殖質與粘土礦物連在一起,或者通過腐殖質表面的功能團比如—COOH、—OH以氫鍵的方式與粘土礦物連在一起。
特性
 土壤膠體
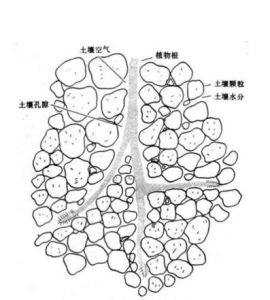
土壤膠體土壤膠體的表面按位置可分為:
外表面:粘土礦物、Fe、Al、Si等氧化物、腐殖質分子暴露在外的表面。
內表面:主要指的是層狀矽酸鹽礦物晶層之間的表面以及腐殖質分子聚集體內部的表面。
比表面:單位重量或單位體積物體的總表面積,很顯然顆粒越小,比表面越大,從P72頁的表3—4可以看出,砂粒與粗粉粒的比表面相對於粘粒來講很小,可以忽略不計,所以土壤的比表面實際上主要取決於粘粒。另外土粒的表面凸凹不平,並非光滑的球體,它的比表面比光滑的球體要大,而且粉粒和粘粒大多呈片狀比表面更大。
另外有些無機膠體(比如蒙脫石類粘土礦物)除了有巨大的外表面,而且表面可向晶層之間擴展,還有巨大的內表面。
有機膠體除了有巨大的外表面,同樣也有巨大的內表面。所以有機膠體同樣有巨大的比表面。比如腐殖質分子比表面可高達1000㎡/g。
由於土壤膠體有巨大的比表面,所以會產生巨大的表面能,我們知道物體內部的分子周圍是與它相同的分子,所以在各個方向上受的分子引力相等而相互抵消。而表面分子則不同,它與外界的氣體或液體接觸,在內外兩面受到的是不同的分子引力,不能相互抵消,所以具有剩餘的分子引力,由此而產生表面能,這種表面能可以做功,吸附外界分子,膠體數量越多,比表面越大,表面能也越大,吸附能力也愈強。
2、土壤膠體的帶電性
土壤膠體的種類不同,產生電荷的機制也不同,根據土壤膠體電荷產生的機制,一般可分為永久電荷和可變電荷。
a:永久電荷:這是由於粘土礦物晶格中的同晶置換所產生的電荷,我們前面介紹過,粘土礦物的結構單位是矽氧四面體和鋁氧八面體,矽氧四面體的中心離子Si4+和鋁氧八面體的中心離子Al3+能被其它離子所代替,從而使粘土礦物帶上電荷。如果中心離子被低價陽離子所代替,粘土礦物帶負電荷;如果中心離子被高價陽離子所代替,粘土礦物帶正電荷。多數情況下是粘土礦物的中心離子被低價陽離子所取代:比如Al3+→Si4+,Mg2+→Al3+,所以粘土礦物以帶負電荷為主,由於同晶置換一般發生在粘土礦物的結晶過程中,存在於晶格的內部,這種電荷一旦形成就不會受到外界環境(pH、電解質濃度)的影響,稱永久電荷。
b:土壤中有些電荷不是永久不變的,這些電荷的數量和性質會隨著介質pH的改變而改變稱為可變電荷,可變電荷是因為土壤膠體向土壤中釋放離子或吸附離子而產生。比如:
①含水氧化矽的解離
pH0=2,一般不產生正電荷.
pH↑,SiO2·H2O的解離越大,所帶負電荷越多。
②含水氧化Fe、Al的解離
比如三水鋁石:Al2O3·3H2OpH0=4.8
③粘土礦物晶面上OH基的解離
高嶺石的表面就有很多OH,能解離出H+,從而帶上負電荷,這是高嶺石帶負電荷的主要原因。
④腐殖質某些功能團的解離,比如:
以上所介紹的膠體電荷的產生都與pH有關,會隨介質pH的改變而改變→可變電荷。
按電性不同可分為:
a:正電荷:土壤中游離的Fe、Al氧化物是產生正電荷的主要物質(酸性條件下解離可帶正電荷),高嶺石裸露在外的鋁氧八面體在酸性條件下的質子化可帶正電荷,有機質——NH2在酸性條件下的質子化也能帶正電荷。
b:負電荷:同晶置換、含水氧化矽的解離、含水氧化Fe、Al在鹼性條件下的解離、粘土礦物表面OH在鹼性條件下的解離、腐殖質功能團中R—COOH、R—CH2—OH、—OH等的解離。
淨電荷:土壤正負電荷的代數和,由於一般情況下土壤帶負電荷的數量遠大於正電荷的數量,所以大多數土壤帶有淨負電荷,只有少數含Fe、Al氧化物較高強酸性土壤上才有可能帶淨正電荷。
3、土壤膠體的凝集作用和分散作用
土壤膠體有兩種不同的狀態,一種是土壤膠體微粒均勻地分散在水中,呈高度分散的溶膠,一種是膠體微粒彼此凝集在一起呈絮狀的凝膠。
土壤膠體受某些因素的影響,使膠體微粒下沉,由溶膠變成凝膠的過程稱土壤膠體的凝集作用,反之,由凝膠分散成溶膠的過程稱膠體的分散作用。
土壤膠體是凝集還是分散主要取決於電動電位:通常土壤膠體是帶負電荷的,土壤膠體之間帶有負的電動電位,是相互排斥的,這種負電動電位越高,排斥力越強,越能成為穩定的溶膠,但當這種負電動電位降低到土壤膠體之間分子引力大於靜電排斥力時,膠體就會相互凝集形成凝膠。
比如向溶液中加入多價離子就能降低負電動電位促使膠體凝集。
凝集力:Fe3+>Al3+>Ca2+>Mg2+>H+>NH4+>K+>Na+
在土壤中土壤膠體處在凝膠狀態時,有利於水穩性團粒的形成,有利於改善土壤結構,所以向土壤中施用石灰能促進膠體凝集,有利於水穩性團粒的形成,對改良土壤結構有良好作用。當土壤膠體處在溶膠狀態時,會使土壤粘結性、粘著性、可塑性增加,降低宜耕期,降低耕作質量。
土壤吸收性能
土壤的吸收性能是指土壤能吸收、保留土壤溶液中的分子和離子,懸浮液中的懸浮顆粒、氣體及微生物的能力。
土壤的吸收性能對土壤肥力和性質有非常重要的作用。
a:土壤的吸收性能與土壤保肥、供肥性關係密切
因為土壤具有吸收性能,所以我們施用的肥料(無論是無機的還是有機的,無論是固體的、液體的還是氣體的)都能長久的保存在土壤中,而且隨時能釋放出來供植物吸收利用。
b:土壤的吸收性能能影響到土壤的酸鹼性以及緩衝性等化學性質
c:土壤的吸收性能能直接或間接地影響到土壤的結構性、物理機械性、水熱狀況等。
土壤吸收性能的類型
按照吸收性能產生的機制,土壤吸收性能分為以下幾種類型:
a.土壤機械吸收性:土壤對物體的機械阻留,土壤機械吸收性能的大小主要取決於土壤的孔隙狀況。孔隙過粗,阻留物少,孔隙過細,會造成阻留物下滲困難,容易形成地面徑流和土壤沖刷。
b.土壤物理吸收性能:指土壤對分子態物質的保存能力包括:
(1)正吸咐:養分集聚在土壤膠體的表面,膠體表面養分的濃度比溶液中大。
(2)負吸咐:土壤膠體表面吸咐的物質較少,膠體表面的養分濃度比溶液中低。
c.土壤的化學吸收性能:易溶性鹽在土壤中轉變成難溶性鹽而沉澱、保存在土壤中的過程,這一過程是以純化學反應為基礎的,稱為化學吸收,比如可溶性的磷酸鹽,在土壤中與Ca2+、Mg2+、Fe2+、Al3+等,發生化學反應生成難溶性的磷酸鈣,磷酸鎂、磷酸鐵、磷酸鋁。化學吸收性能雖然能使易溶性養分保存下來,減少流失,但同時也降低了這些養分對植物的有效性,所以在生產上要儘量避免有效養分的化學固定的產生,但化學吸收也有一些好處,比如H2S、Fe2+對水稻根系有毒害作用,但是在水田嫌氣條件下H2S+Fe2+→FeS↓降低它們的毒害作用。
d.土壤的物理化學吸收性能:土壤對可溶性物質中的離子態養分的保持能力;由於土壤膠體帶正電荷和負電荷,能吸咐土壤溶液中電性相反的離子,被吸咐的離子還能與土壤溶性中的同電性的離子發生交換而達到動態平衡,這一過程以物理吸咐力基礎,但又表現出化學反應的某些特徵,所以稱為土壤的物理化學吸咐性能或土壤的離子交換作用。
f.生物吸收性能:是土壤中植物根和微生物對營養物質的吸收,它具有選擇性和創造性,同時能累積和集中養分。
上述幾種土壤吸收性能並不是孤立存在的,而且相互聯繫,相互影響的,在這幾種土壤吸收性能中對土壤的供肥性和保肥性貢獻最大的是土壤的物理化學吸收性能。
土壤的物理化學吸收性能
土壤的物理化學性能其實質就是土壤的離子交換作用包括:
(1)土壤的陽離子交換:帶負電荷的土壤膠體所吸咐的陽離子與土壤溶液中的陽離子發生交換而達到動態平衡的過程。
(2)土壤的陰離子交換:帶正電荷的土壤膠體所吸咐的陰離子與土壤溶液中的陰離子發生交換而達到動態平衡的過程。
1.土壤的陽離子交換作用:
通常土壤所帶負電荷的數量遠比正電荷多,土壤膠體表面的負電荷能吸咐土壤溶液中的陽離子以中的電性,被吸咐的陽離子在一定的條件下也能被土壤溶液中其它的陽離子交換下來→土壤的陽離子交換作用。
比如土壤膠體上原來吸咐有Ca2+,當我們施用K2SO4後,Ca2+就能被K+交換下來而進入土壤溶液。
土壤溶液中的離子轉移到土壤膠體上→吸咐
土壤膠體上吸咐的離子轉移到土壤溶液→解吸
A.土壤陽離子交換作用的特點:
a.可逆反應:也就是說已吸咐在土壤膠體上的陽離子當土壤溶液的組成和濃度發生改變時,完全可以被其它的陽離子代換下來而進入土壤溶液,這一點在植物營養上有很重要的作用,它使被吸咐的離子並不會失去對植物的有效性,植物對養分的吸收主要是吸收土壤溶液的養分,土壤膠體表面的養分絕大部分需要轉移到土壤溶液中才能被吸收,由於陽離子交換反應是可逆反應,使得被吸咐的陽離子,完全可以被其它的陽離子交換下來,重新進入土壤溶液供植物吸收利用,所以被吸咐的陽離子並沒有失去對植物的有效性。
b.等當量交換:也就是說一個Ca2+可交換兩個K+,1molFe3+可交換3molK+或Na+。
c.符合質量作用定律
d.反應迅速,能迅速達到平衡
B.土壤的陽離子交換能力
指一種陽離子將土壤膠體上的另外一種陽離子交換下來的能力。
影響土壤陽離子交換能力的因素主要有以下幾個方面:
a.電荷數量:根據庫侖定律,離子電荷價越高,受膠體的吸咐能力越大,交換能力越大,所以M3+>M2+>M+。
b.離子半徑和水合半徑:對於同價的離子,離子半徑越大,水合半徑越小,交換能力越強:
Fe3+>Al3+>H+>Ca2+>Mg2+>NH4+>K+>Na+
在這一系列中,H+是例外,H+的交換能力>Ca2+、Mg2+,因為H+的半徑小,水化程度也弱,運動速度快,所以交換能力強,所以離子的運動速度也是影響離子交換能力的一個因素。
c.離子濃度,因為離子交換受質量作用定律支配,所以對交換能力弱的陽離子,增加它的濃度,也可以交換那些交換能力強的陽離子。
C.土壤的陽離子交換量:(CEC)
通常是指在一定的pH條件下,1kg乾土所能吸咐的全部交換性陽離子的厘摩爾數,單位:Cmol/kg。
影響土壤陽離子交換量的因素:
a.膠體的類型:不同的土壤膠體所帶負電荷的數量不同,陽離子交換量也不同
負電荷數量:腐殖質>蛭石>蒙脫石>伊利石>高嶺石。
陽離子交換量:腐殖質>蛭石>蒙脫石>伊利石>高嶺石
b.土壤質地:質地越粘重,粘粒越多,CEC越大,另外含OM高的土壤,CEC也比較大。
c.土壤pH:pH會影響到可變負電荷的數量,從而影響到土壤的陽離子交換量,pH上升可以增加土壤可變負電荷的數量,從而使土壤陽離子交換量增加。
土壤的陽離子交換量,基本上代表了土壤能夠吸咐陽離子的數量,也就是土壤的保肥能力。
D.土壤的鹽基飽和度
土壤膠體上吸咐陽離子基本上可分為兩類:
當土壤膠體上吸咐的陽離子,全部是鹽基離子時,土壤呈現鹽基飽和狀態,這種土壤稱鹽基飽和土壤;當土壤膠體上吸咐的陽離子,一部分是鹽基離子,另一部分是致酸離子時,土壤呈現鹽基不飽和狀態,這種土壤稱為鹽基不飽和土壤。
土壤鹽基飽和的程度,一般用鹽基飽和度來表示,它指的是交換性鹽基離子占陽離子交換量的百分率。
鹽基飽和度的作用:
a.可以反映土壤的酸鹼性:鹽基飽和度的高低實際上也就反映出了致酸離子含量的高低,所以能反應出土壤的酸鹼性:
北方土壤:鹽基飽和度大,土壤pH較高
南方土壤:鹽基飽和度低,土壤pH低
b.判斷土壤肥力水平
鹽基飽和度>80%→肥沃土壤,50—80%→中等肥力水平,<50%肥力水平較低。
E.交換性陽離子的有效度
土壤膠體表面吸咐的離子,可以通過離子交換進入土壤溶液供植物吸收利用,所以被土壤膠體吸咐的陽離子,不會失去對植物的有效性,但是被土壤膠體吸咐的陽離子的有效度,並非在任何條件下都完全相同,從土壤角度講影響交換性陽離子有效度的因素主要有以下一些方面:
a.離子飽和度(土壤膠體上吸咐的某一種離子的總量占土壤陽離子交換量的百分率)
植物對養分的吸收雖然可以通過根系與土壤膠體之間接觸代換而被吸收,但是通過接觸代換而吸收的養分數量很少,植物主要還是吸收土壤溶液中的養分,也就是說土壤膠體上吸咐的陽離子,必須要解吸到土壤溶液中才能被吸收利用。
土壤膠體上某種離子的飽和度越大,被解吸的機會越大,該離子的有效度越大,所以交換性陽離子的有效度不僅僅與該種離子的絕對數量有關,更主要的還取決於該種離子的飽和度:
雖然交換性Ca2+的絕對數是乙土壤>甲土壤,但是Ca2+的飽和度甲土壤>乙土壤,所以Ca2+的有效度,甲土壤>乙土壤。
所以施肥要相對集中施用,增加離子飽和度,能提高肥效。
b.陪補離子效應
土壤膠體上同時吸咐著多種離子,對於其中任何一種離子來講,其它的各種離子都是它的陪補離子。比如土壤膠體上吸咐有K+、Ca2+、NH4+、Na+那么K+的陪伴離子就是Ca2+、NH4+、Na+。NH4+的陪伴離子就是K+、Ca2+、Na+。
某一種交換性陽離子的有效度,與陪補離子的種類關係密切,一般來講陪補離子與土壤膠體之間的吸咐力越大,越能提高被陪離子的有效度。
比如:假如K+的陪補離子是Ca2+,由於Ca2+與土壤膠體之間的吸咐力>K+,所以K+容易被交換下來,從而提高K+的有效度。
如果K+的陪補離子是Na+,由於Na+與土壤膠體間的吸咐力<K+,K+不易被交換下而降低K+的有效度。
c.粘土礦物的類型
不同的粘土礦物由於晶體構造不同,吸咐陽離子的牢固程度也不同,在一定的鹽基飽和度範圍內,蒙脫石類粘土礦物吸咐的陽離子,一般位於晶層之間,吸咐比較牢固,有效度相對較低,而高嶺石類粘土礦物吸咐的陽離子一般位於晶體外表面,吸咐力弱,有效度相對較高。
2.土壤對陰離子的交換吸咐
A.土壤對陰離子的靜電吸咐(非專性吸咐)
土壤膠體雖然以帶負電荷為主,但是在某些特定條件下土壤膠體也可帶正電荷。
比如Fe,Al,氧化物在酸性條件下的解離,能帶正電荷:pH<4.8,Al2O3.3H2O→Al(OH)2++2H+.
又比如高嶺石在酸性條件下表面—OH的解出,能帶正電荷。
腐殖質分子中R—NH2的質子化能帶正電荷:
R—NH2+H+→RNH3+
這樣這些帶正電荷的土壤膠體就能通過靜電引力而吸咐陰離子,這種通過靜電引力而對陰離子產生的吸咐我們稱為土壤對陰離子的非專性吸咐,被吸咐的陰離子,可被其它的陰離子所代換,屬交換性的陰離子。
影響陰離子非專性吸咐的因素,主要有以下兩個方面:
a.陰離子的種類:一般陰離子的價數越多,吸咐力越強;在同價陰離子中,水含半徑小的離子吸咐力強。
F->草酸根>檸檬酸根>H2PO4->HCO3->H2BO3->CH3COO->SO42->Cl->NO3-
b.帶正電荷土壤膠體的種類:
一般來講帶正電荷的土壤膠體主要是Fe、Al、Mn的氧化物,所以含Fe、Al、Mn的氧化物高的強酸性土壤容易產生陰離子的非專性吸咐。
B.土壤膠體對陰離子的專性吸咐

