吸附等溫式種類
吸附等溫式是在溫度固定的條件下,表達吸附量同溶液濃度之間關係的數學式。目前已提出不同類型的數學式,各有其適用範圍.
常用的有以下兩種:
①弗恩因德利希(H.M.F.Freundich)吸附等溫式,在中等濃度時,其經驗公式可表述為 (n>1)若取對數,則 為一直線方程式。式中:C是作用達到平衡時溶液的濃度;K、n是在一定範圍內表示吸附過程的經驗係數。
②朗繆爾(I.Langmuir)吸附等溫式,其基本形式可表達為 式中:Q為任一平衡狀態時的吸附量;Qo為單位表面上達到飽和時最大極限吸附量;b=Ka/ Kb為吸附與解吸的比例關係的比值。該方程能較好地適合各種濃度,並且式中每一項都有較明確的物理意義。吸附等溫式是定量研究環境中膠體對各種元素遷移的影響的重要方法。
物質在界面上富集的現象叫做吸附。溶液表面的吸附導致表面濃度與內部濃度不同,這種不同稱為表面過剩。
吸附等溫式定義
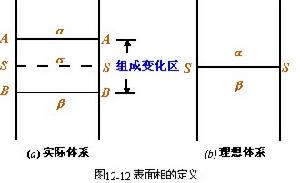
由於表面吸附,造成在溶液與氣相的交界處存在著一個濃度和性質與兩體相不同的表面薄層,它的組成和性質是不均勻的。此表面層也可理解為是兩體相的過渡區域。如圖12-12所示。
 12-12
12-12從另一角度定義了表面相,將表面相理想化為一無厚度的幾何平面SS,即將表面層與本體相的差別,都歸結於發生在此平面內。根據這個假設,吉布斯套用熱力學方法導出了等溫條件下溶液表面張力隨組成變化關係,稱為"吸附等溫式"。
