簡介
可逆電極的本質特徵主要有兩個,即單一電極和反應可逆。所謂單一電極即電極上只能發生一種電化學反應,能同時發生多個反應的多重電極不可能構成可逆電極。其次,可逆電極的反應必須可逆,即充電和放電時發生同一反應只是方向相反。此外,通常還要求可逆電極必須能夠迅速建立、恢復和穩定地保持平衡態,這就要求可逆電極必須具有較高的交換電流密度及較高的平衡離子濃度。
研究可逆電極時還必須明確所謂電極並非僅指固相的電極極板,一個電極通常應包含導體、活性物質和電解質溶液3個部分,這3部分的特徵也是電極分類的基本依據之一 。
第一類電極
該類電極通常包括金屬電極、氣體電極和汞齊電極等,以金屬電極為其典型代表。
金屬電極構成簡單,只需將金屬板浸在含該金屬相應陽離子的溶液中即可構成。該類電極的導體同時就是活性物質。
該類電極的最顯著特徵包括:
(1)在電極電勢的建立過程中往往有離子在溶液和金屬極板間的遷移,電極與溶液中的金屬陽離子之間建立平衡,電極電勢與溶液中金屬陽離子的濃度存在回響關係並符合Nernst方程。
(2)電極只具有第一類導體(金屬)和第二類導體(電解質溶液)間的唯一相界面,屬兩相電極。
(3)該類電極的電極反應都是單質和其離子間的轉化反應。
可見,氣體電極與金屬電極、汞齊電極、金屬配合物電極等第一類電極在電極的構成和基本特徵方面存在較大差異,將其歸為第一類電極有些勉強,因此有作者提出將氣體電極單獨列為一類的觀點。但即使如此,氣體電極間除了同屬三相電極這一共性之外,更多的仍是差異。
考慮到這些電極在電極反應上都是由單質與離子間直接建立平衡對應關係,多數作者支持將氣體電極仍歸入第一類電極 。
第二類電極
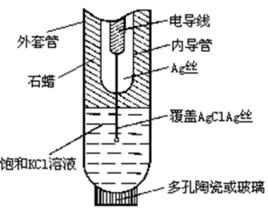
包括難溶鹽電極和難溶氧化物電極兩種,以難溶鹽電極為代表。
難溶鹽電極系將難溶鹽覆蓋的金屬電極浸在含難溶鹽陰離子的溶液中構成。該類電極的金屬既是導體又是活性物質。
該類電極的基本特徵包括:
(1)電極中存在金屬難溶鹽或難溶氧化物、難溶鹽或難溶氧化物電解質溶液兩個界面,屬於三相電極。
(2)電極電勢與溶液中難溶鹽陰離子或OH一間有回響關係,符合Nernst方程 。
第三類電極
又稱氧化還原電極。典型的氧化還原電極。電極由導體(通常為鉑電極)浸在含有同種物質不同價態物種的混合溶液中構成。
該類電極的特點是:
(1)只有第一類導體和第二類導體間的一個相界面和兩相。
(2)在電極反應過程中只有電子而無其他物質(陰、陽離子)穿越界面。
(3)電極電勢由物質不同氧化態的濃度(或活度)比決定,符合Nemst方程 。
第四類電極
即膜電極。該類電極通常由內參比電極、內充液和具有離子選擇性回響的薄膜組成。常見的有玻璃膜電極、其他固體膜電極、離子交換膜電極、氣敏電極和液體膜電極等。
該類電極與前3類電極存在很大的不同,其主要特點是:
(1)電極電勢由膜電勢決定,而膜電勢由溶液中離子和膜中離子的交換平衡決定,膜電極的電極電勢由待測溶液中的選擇性離子的濃度決定,在電極測量的有效範圍內符合N ernst方程。
(2)在電極電勢建立的整個過程中沒有電子轉移發生。
第五類電極
又稱嵌入電極,即發生嵌入反應的電極。所謂嵌入反應(intercalation reaction)就是客體粒子(也稱嵌質,主要是陰、陽離子)嵌入主體晶格(也稱嵌基)生成非化學計量化合物的反應。
嵌入反應的研究歷史最早可追溯到1841年發現的硫酸根離子嵌入石墨晶格的反應。但對嵌入反應進行比較深入系統的研究還是20世紀70年代以後的事。20世紀70年代又提出以嵌基或嵌入化合物作為二次電池電極 。