概述
利用卡爾費休法測定物質中水分是一種重要而靈敏的化學分析方法,但除了有一個非常好的測定儀器外,必須對測定的物質中有無干擾物質存在,根據物質中水分的含量確定適當的進樣量,克服各種影響測定精度的因素,細心操作,才能得到好的測定結果。1935年卡爾-費休(KarlFischer)首先提出了利用容量分析測定水分的方法,這種方法即是GB6283《化工產品中水分含量的測定》中的目測法。目測法只能測定無色液體物質的水分。後來,又發展為電量法。隨著科技的發展,繼而又將庫侖計與容量法結合起來推出庫侖法。這種方法即是GB7600《運行中變壓器油水分含量測定法(庫侖法)》中的測試方法。分類目測法和電量法統稱為容量法。卡氏方法分為卡氏容量法和卡氏庫侖法兩大方法。兩種方法都被許多國家定為標準分析方法,用來校正其他分析方法和測量儀器。
卡氏庫侖法測定水分是一種電化學方法。其原理是儀器的電解池中的卡氏試劑達到平衡時注入含水的樣品,水參與碘、二氧化硫的氧化還原反應,在吡啶和甲醇存在的情況下,生成氫碘酸吡啶和甲基硫酸吡啶,消耗了的碘在陽極電解產生,從而使氧化還原反應不斷進行,直至水分全部耗盡為止,依據法拉第電解定律,電解產生碘是同電解時耗用的電量成正比例關係的。其反應如下:
HO+I+SO+3CHN→2CHN·HI+CHN·SO
CHN·SO+CHOH→CHN·HSOCH
在電解過程中,電極反應如下:
陽極:2I -2e→I
陰極:I+2e→2I
2H +2e→H↑
從以上反應中可以看出,即1摩爾的碘氧化1摩爾的二氧化硫,需要1摩爾的水。所以是1摩爾碘與1摩爾水的當量反應,即電解碘的電量相當於電解水的電量,電解1毫摩爾碘需要2×96493毫庫侖電量,電解1毫摩爾水需要電量為2×96493毫庫侖電量。
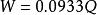 卡爾·費休法
卡爾·費休法樣品中水分含量按下列公式計算:
式中:W---樣品中的水分含量,μg;
Q---電解電量,mC;
按水的分子量為18.015 g/mol 計算;
操作
費休法屬碘量法,其基本原理是利用碘氧化二氧化硫時,需要—定量的水參加反應:
I + SO + 2HO → 2HI + HSO4
上述反應是可逆的。當硫酸濃度達到0.05%以上時,即能發生逆反應。如果我們讓方程按照一個正方向進行,需要加入適當的鹼性物質以中和反應過程中生成的酸。在體系中加入吡啶,這樣就可使反應向右進行。實驗證明,吡啶是最適宜的試劑,同時吡啶還具有可與碘和二氧化硫結合以降低二者蒸氣壓的作用。因此,試劑必須加進甲醇或另一種含活潑OH基的溶劑,使硫酸酐吡啶轉變成穩定的甲基硫酸氫吡啶。
卡爾·費休水分測定法是以甲醇為介質以卡氏液為滴定液進行樣品水分測量的一種方法。此方法操作簡單,準確度高,廣泛套用於醫藥、石油、化工、農藥、染料、糧食等領域。尤其適用於遇熱易被破壞的樣品,不僅測出自由水, 也可測出結合水,常被作為水分特別是痕量水分的標準分析方法。但不適於含VC等強還原物的樣品。
卡爾費休試劑是一種測定某些物質中微量水份用的試劑,其成份有:甲醇、吡啶、碘、二氧化硫。終點判定方法有目測法和電位法兩種。
主要成分有I,SO,CHN,CHOH
卡爾費休法的基本原理是I氧化SO時,需要定量的HO
I+SO+2HO=2HI+HSO
此反應是可逆反應,要使反應正向進行,需要加入適當的鹼性物質中和反應產生的酸,吡啶(CHN)可滿足此要求,加入甲醇可避免副反應發生
卡爾費休試劑因含有I2而顯棕色,當I2,SO,HO反應後,I棕色褪去。
此法以棕色出現為滴定終點
卡爾費休法是非水滴定法,所有容器都需乾燥,1L卡爾費休試劑在配製和保存過程中若混入6g水,試劑就會失效。
卡爾費休試劑是測定有機物中微量水分的試劑,故又稱水試劑,也稱卡氏試劑。初始的水試劑主要由碘,二氧化硫,甲醇,吡啶按一定比例配製而成。這種試劑有惡臭而且有很大的毒性,穩定性差,保存期在三個月內,而且不適用醛,酮類有機物的測定,用戶帶來儲存,使用上的不便。隨著全自動卡氏分析儀的問世,對卡氏試劑要求也相應提高。所以人們紛紛研製各種類型的水試劑,由於水試劑的型號,表示方法各異,使用時,一定要看各廠家的詳細說明。
卡爾費休試劑:
單 組: 無吡啶F≥3 500ml
甲乙液: 無吡啶 F≥3 500ml*2
A+B液:無吡啶 F≥3 500ml*2
結果
卡爾費休法測定各種物質中微量水分的原理:在水存在時,即樣品中的水與卡爾費休試劑中的SO與I產生氧化還原反應。
I + SO + 2HO → 2HI + HSO
但這個反應是個可逆反應,當硫酸濃度達到0.05%以上時,即能發生逆反應。如果我們讓反應按照一個正方向進行,需要加入適當的鹼性物質以中和反應過程中生成的酸。經實驗證明,在體系中加入吡啶,這樣就可使反應向右進行。
3 CHN+HO+I+SO → 2氫碘酸吡啶+硫酸酐吡啶
生成硫酸酐吡啶不穩定,能與水發生反應,消耗一部分水而干擾測定,為了使它穩定,我們可加無水甲醇。
硫酸酐吡啶 + CHOH(無水)→ 甲基硫酸吡啶
總反應式:
I+SO+HO+3吡啶+CHOH→2氫碘酸吡啶+甲基硫酸吡啶
從反應式可以看出1mol水需要1mol碘,1mol二氧化硫和3mol吡啶及1mol甲醇而產生2mol氫碘酸吡啶、1mol甲基硫酸吡啶。這是理論上的數據,但實際上,SO、吡啶、CHOH的用量都是過量的,反應完畢後多餘的游離碘呈現紅棕色,即可確定為到達終點。
I:SO:CHN = 1:3:10
