定義
烯類單體間相互反應生成一種高分子化合物,叫做加聚反應。加聚反應由一種引發劑進行引發後,單體一一逐個與聚合鏈的頂端發生加成反應,形成聚合物。
另外,單體間相互反應生成高分子化合物,同時還生成小分子(水、氨等分子)的反應叫縮聚反應。加聚反應:小分子的烯烴或烯烴的取代衍生物在加熱和催化劑作用下,通過加成反應結合成高分子化合物的反應,叫做加成聚合反應。
簡介
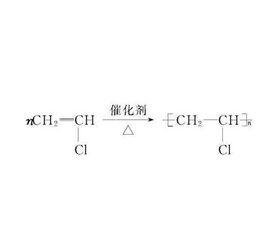
如:nCH=CH→[CH2-CH]
若n與n不同,則是化合物
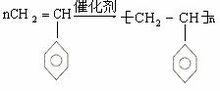 聚合反應
聚合反應CH=CH是單體(小分子),-CH-CH-是鏈節,n是聚合度(小分子個數),聚乙烯是高聚物。.
n一般成千上萬
註:一般公式nCH=CH → [ CH - CH ] 的中括弧是有橫線的,那表明的了不飽和,n就是表明無數互相連線。
加聚反應主要包括陽離子聚合 陰離子聚合 、自由基聚合 和金屬催化劑聚合 四種,分別適用於不同的單體。
1. 陽離子聚合
陽離子聚合使用的引發劑通常是較強的路易斯酸(如質子、五氟化磷,等)或者發煙硫酸。在酸性條件下,質子或路易斯酸攻擊單體雙鍵或環,發生加成反應,自身穩定下來卻又形成了一個新的路易斯酸,又繼續攻擊下一個單體。經過多次重複反應,生成一條聚合鏈(下圖中單體不同,但反應機制相同)。
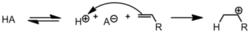 陽離子聚合被一個質子引發,形成碳正離子
陽離子聚合被一個質子引發,形成碳正離子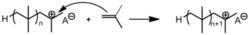 碳正離子繼續攻擊單體,碳鏈增長
碳正離子繼續攻擊單體,碳鏈增長當聚合鏈碰到路易斯鹼的時候,碳鏈頂端得到配位鍵,反應終止。
 副反應也可能終止加聚反應
副反應也可能終止加聚反應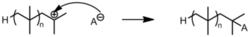 反應被路易斯鹼終止。
反應被路易斯鹼終止。另外,副反應也能導致聚合終止
2. 陰離子加聚反應
這種加聚反應和陽離子加聚反應極為相似。不同的是,該反應使用的是一種路易斯強鹼(如乙醇鈉、二異丙基胺鈉、氨基鈉、格氏試劑、有機鋰試劑等)路易斯鹼和一個單體反應,產生一個新的路易斯鹼;而新的路易斯鹼又會繼續攻擊下一個單體,發生加成反應,以此類推。反應會被能呈酸性的物質(如路易斯酸、水合氫離子等)終止。
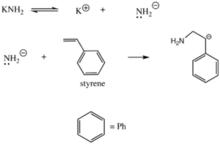 氨基鉀導致苯乙烯聚合,是陰離子聚合
氨基鉀導致苯乙烯聚合,是陰離子聚合3. 自由基聚合
自由基聚合與以上兩種聚合反應也非常相似。不同的是該反應首先把聚合物和一種能在特殊條件下形成自由基的物質 混合在一起(該物質稱為自由基引發劑)。混合物通過特殊反應條件(如加熱、紫外線等等),裡面的自由基引發劑可以生成自由基。常見的自由基引發劑包括二苯甲酮、過氧化苯甲醯、過硫酸銨等。
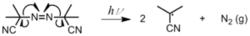 這種物質在高溫或紫外線下,形成自由基。
這種物質在高溫或紫外線下,形成自由基。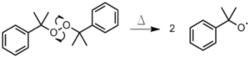 這種物質在高溫或紫外線下,形成自由基。
這種物質在高溫或紫外線下,形成自由基。 苯基自由基攻擊苯乙烯形成新自由基
苯基自由基攻擊苯乙烯形成新自由基自由基攻擊一個單體,發生加成反應,形成一個新的自由基。這個新的自由基又能夠攻擊下一個單體。持續的反應可以形成聚合鏈。
與陽離子、陰離子加聚反應不同,自由基聚合不需要特定的終止反應。兩個自由基的單電子就可以形成一個共價鍵,使反應終止。
4. 金屬催化劑加聚反應
這種加聚反應和以上三種加聚反應均有較大不同。反應使用一種特定的過渡金屬配位化合物作為引發劑,單體一般只為烯烴類化合物而不包含環狀化合物。陽離子催化、陰離子催化和自由基催化發生的地點都在聚合鏈的“尾巴”處,而金屬催化則發生在聚合鏈的“頭部”,也就是金屬離子所在的地方。幾乎所有此類金屬引發劑都是金屬離子和環戊二烯形成的化合物。
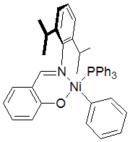 有些金屬催化劑不含環戊二烯
有些金屬催化劑不含環戊二烯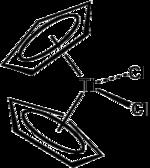 這種物質和烷基鋁混合,可催化加聚反應
這種物質和烷基鋁混合,可催化加聚反應什麼時候使用哪種引發劑,是有單體決定的。某些單體會更加適合其中一種或幾種聚合方法。