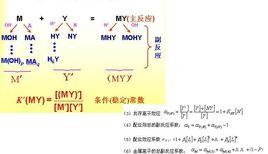
基本定義
副反應係數用於表示副反應對主反應進行程度的影響,副反應係數在配位滴定、氧化還原滴定、沉澱重量法中均有套用。副反應係數定義的提出在主反應進行的同時,許多副反應也在進行,副反應會改變主反應的反應程度。副反應進行的程度用副反應係數α表示。主反應中的反應物和生成物都可能發生副反應,不管是反應物還是生成物,都有兩類存在形式,一類是主反應中期望的存在形式,另一類是發生了副反應的各種存在形式。因此,副反應係數定 義為:主反應中反應物或生成物所有存在形式濃度總和與主反應中期望的反應物(或生成物)存在形式濃度之比,即為α。
副反應越嚴重,副反應產物就越多。主反應中反應物(或生成物)所有存在形式濃度總和遠大於主反應中期望的反應物(或生成物)存在形式濃度,則副反應係數α越大。若沒有發生副反應,主反應中反應物(或生成物)只有一種存在形式,即主反應中期望的反應物(或生成物)存在形式,則α=1。
種類及計算
配位滴定中的副反應係數
配位滴定過程中除了金屬離子M和配體EDTA的配位反應外,還有配位效應、酸效應、共存離子效應等副反應。要準確表示滴定反應的進行程度,我們需要計算出條件穩定常數,而計算條件穩定常數需要知道副反應係數。反應物M及Y的副反應不利於主反應的進行,而生成物MY的副反應有利於主反應的進行。此處用αM表示金屬離子的副反應係數,αY表示EDTA的副反應係數,αMY表示MY的副反應係數。
1.αY的計算
(1)酸效應係數αY(H)的計算:由於氫離子的存在,與Y發生了副反應,使Y參加主反應能力降低的現象。
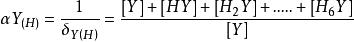 副反應係數
副反應係數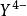 副反應係數
副反應係數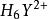 副反應係數
副反應係數αY(H)=,這相當於逐步結合一個氫離子至的每一步的k。
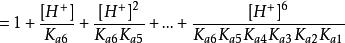 副反應係數
副反應係數所以αY(H)
(2)共存離子效應係數αY(N):當溶液里存在其他的金屬離子N時,Y與N也能發生配合物,導致Y參加主反應的能力降低。
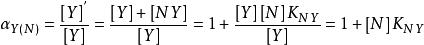 副反應係數
副反應係數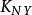 副反應係數
副反應係數所以αY(N)取決於干擾離子N的濃度和干擾離子N與EDTA的穩定常數.
因此,如果Y與N以及氫離子同時發生反應,αY的計算如下:
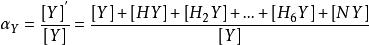 副反應係數
副反應係數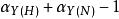 副反應係數
副反應係數=
當兩者相差很大時,可以忽略其中一種副反應係數,簡化計算。
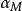 副反應係數
副反應係數2.的計算
其他配位劑L與M發生配位反應,使M參與主反應能力降低。主要反映了除EDTA之外溶液里其他配位劑和羥基的影響,將羥基也視為一種配位劑L。
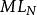 副反應係數
副反應係數首先要了解累積效應常數,M與L可以不斷配合,從ML到,每一次結合都存在一個k值,而累計效應常數β的含義是:
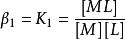 副反應係數
副反應係數一級累計效應常數
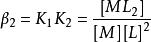 副反應係數
副反應係數二級累積效應常數
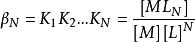 副反應係數
副反應係數n級為
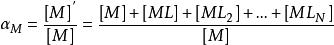 副反應係數
副反應係數所以,
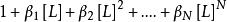 副反應係數
副反應係數=
實際上,M也會同時發生許多的副反應,依據實際情況簡單處理。
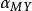 副反應係數
副反應係數3.的計算
主要與溶液中的PH有關。當溶液酸度很高時,MY會與氫離子生成酸式配合物MHY.
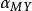 副反應係數
副反應係數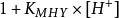 副反應係數
副反應係數=.
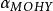 副反應係數
副反應係數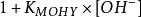 副反應係數
副反應係數同理,當溶液鹼度很高時,可以形成MOHY。=.
但是實際上,MHY與MOHY都很不穩定,可以直接忽略。
氧化還原滴定中的副反應係數
氧化還原滴定中計算條件電極電勢時要用到氧化態及還原 態的副反應係數。
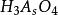 副反應係數
副反應係數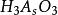 副反應係數
副反應係數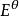 副反應係數
副反應係數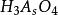 副反應係數
副反應係數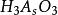 副反應係數
副反應係數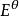 副反應係數
副反應係數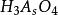 副反應係數
副反應係數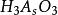 副反應係數
副反應係數比如:根據電對/的標準電極電勢(/)計算該電對在PH=8時的條件電 勢(/).
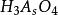 副反應係數
副反應係數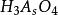 副反應係數
副反應係數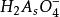 副反應係數
副反應係數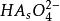 副反應係數
副反應係數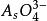 副反應係數
副反應係數根據電極反應式可知,氧化態的期望形式為,由於解離,氧化態有,,,四種存在形式,則副反應係數為
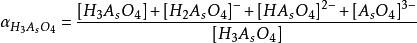 副反應係數
副反應係數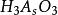 副反應係數
副反應係數同理,還原態的副反應係數為
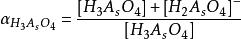 副反應係數
副反應係數沉澱重量法中的副反應係數
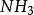 副反應係數
副反應係數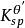 副反應係數
副反應係數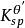 副反應係數
副反應係數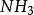 副反應係數
副反應係數在沉澱重量法中,計算難溶電解質的溶解度時會用到條件溶度積,而計算也需要副反應係數。計算AgI在中的溶解度,此處的酸效應可忽略。
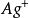 副反應係數
副反應係數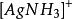 副反應係數
副反應係數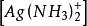 副反應係數
副反應係數根據反應式,可知銀離子為期望形式由於配位效應副反應,溶解出的銀有,,三種存在形式,則銀離子的副反應係數為
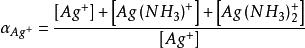 副反應係數
副反應係數套用
隨著副反應的逐步認識的加深,和副反應係數的準確計算,有助於在滴定分析中準確把握實際的數值,對工業生產有重要的促進意義。