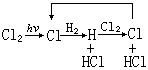
鏈反應
例如反應H2+Cl2─→2HCl,開始用光引發,產生氯原子:Cl2+hv─→2Cl
隨之發生以下反應:Cl+H2─→H+HCl
H+Cl2─→Cl+HCl
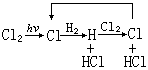
分類 直鏈反應 在鏈反應中,活性組分自由基不斷再生,自由價保持不變,例如以下反應:
Cl·+H2─→HCl+H·
H·+Cl2─→HCl+Cl·
反應中單自由價的氯原子(或氫原子)產生單自由價的氫原子(或氯原子)。支鏈反應 在鏈反應中,當一個單自由價的鏈載體和分子反應時,能產生多於一個的新自由基,為支鏈反應,例如下列反應:
H+O2─→HO+O
O+H2─→OH+H
再加上其他鏈傳遞過程:OH+H2─→H2O+H,就可將H-O2反應圖解如下: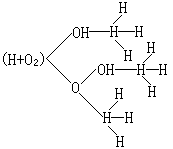
退化支鏈反應 在鏈的支化過程中生成了比鏈載體更為穩定的活潑分子(如有機過氧化物),而這種活潑性分子又能分解出多於一個的支鏈載體,使支化過程得以進行。但這種分子分解產生鏈載體的過程,比鏈載體所進行的反應要緩慢得多。這就是退化支鏈反應。某些有機物的液相氧化反應屬於此類反應。
機理 直鏈反應機理 可分為:
①鏈引發,是依靠熱、光或電的作用,在反應體系中產生第一個作為鏈載體的自由基的反應,一般為穩定分子分解為自由基的反應:
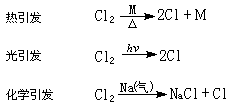
②鏈的持續反應,是鏈載體自由基的再生反應,即舊鏈載體的消失和新鏈載體的產生同時進行的反應,一般是自由基與飽和分子間的反應,例如:
CH3+C2H6─→CH4+C2H5
C2H5─→C2H4+H
由於在直鏈反應的持續反應中自由價守恆,導致鏈反應的持續進行。③鏈的終止反應,是鏈載體的消亡過程,例如:
Cl+Cl+M─→Cl2+M
對生成的簡單分子來說,反應所釋放的能量須傳給第三種物體M,產物分子才能穩定。終止反應既可在體相發生,也可在表面上發生,後者往往在體系壓力較低、分子運動的平均自由程與容器的線度相當時占優勢,例如以下反應: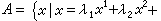
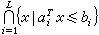
在鏈反應體系中加入某一組分(阻化劑)後,引起反應的減慢,稱為阻化作用。一般,在鏈反應中痕量的阻化劑就能引起反應速率的顯著降低,阻化作用是揭示鏈反應機理的一種常用手段。一般用作阻化劑的是一氧化氮、丙烯和甲苯等。
有機物鏈式裂解反應機理 對於氣態有機物(如烴、酮、醛、醇、醚等)的熱分解反應,F.O.賴斯和K.F.赫茨菲爾德提出以下的普遍的鏈式機理:
鏈的引發 M1─→R1+M2
鏈的傳遞 R1+M1─→R1H+R2
R2─→R1+M3
鏈的終止 R1+R2─→M4
2R1─→M5
2R2─→M6
式中R代表自由基,M1、M2、…M6代表不同的穩定組分。終止反應在不同條件下總是以其中一個為主,並可推導出不同的速率方程。將實驗所得的速率方程與它對照,即可判斷出何種機理更為可能。以乙醛熱分解為例,按賴斯和赫茨菲爾德提出的機理,可列出以下反應:
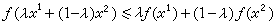 (1)
(1)
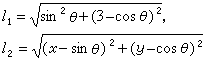 (2)
(2)
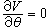 (3)
(3)
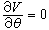 (4)
(4)
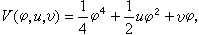 (5)
(5)
r=k2(k1/k4)1/2【CH3CHO】3/2
根據反應(1)、(2)、(3)、(5)可得出速率方程:r=k2(k1/k5)1/2【CH3CHO】1/2
式中k1、k2、k3、k4、k5為反應速率常數。若實驗測得不同條件下反應速率與乙醛濃度、反應級數的關係,則不難判斷在該條件下乙醛熱分解的反應機理。鏈式加成聚合反應機理 高分子化合物是由多個單體連線而成的,其加成聚合反應中有一類是自由基無支化的鏈式反應,例如乙烯類單體M的加成聚合,通過加入能產生自由基R的引發劑I,引發以下鏈式聚合反應:
引發 I─→2R
持續 R+M─→RM
RM+M─→RM2
………………
終止 RMi+RMj─→R2M(i+j)
這類反應的研究對開創高分子時代曾產生過巨大的影響。