概述
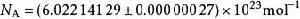 亞佛加德羅常數
亞佛加德羅常數在物理學和化學中,亞佛加德羅常數(符號: N或 L)的定義是一個比值,是一個樣本中所含的基本單元數(一般為原子或分子) N,與它所含的物質的量 n(單位為摩爾)間的比值,公式為 N= N/ n。因此,它是聯繫一種粒子的摩爾質量(即1摩爾時的質量),及其質量間的比例常數。亞佛加德羅常數用於代表1摩爾物質所含的基本單元(如分子或原子)之數量,而它的數值為:
在一般計算時,常取6.02×10 或6.022×10 為近似值。
較早的定義中所定的另一個數值為阿伏伽德羅數,歷史上這個詞與阿伏伽德羅常量有著密切的關係。當國際單位制(SI)修訂了基本單位後,所有化學數量的概念都必需被重定義。阿伏伽德羅數的新定義由讓·佩蘭所下,定為2克分子氫所含的分子數。跟它一樣的是,12克同位素碳-12所含的原子數量。因此,阿伏伽德羅數是一個無量綱的數量,與用基本單位表示的阿伏伽德羅常量數值一致。科學家還在不斷精確化亞佛加德羅常數,最新的研究論文發現其數值為6.02214082(11)×10 ,括弧中的數字表示最後兩位估值數字的不確定性。
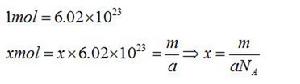 亞佛加德羅常數
亞佛加德羅常數亞佛加德羅常數的定義值是指0.012千克¹²C所含的原子數,6.02×10²³。這個數值是亞佛加德羅常數的近似值,兩者是有區別的。亞佛加德羅常數的符號為 N,不是純數。其單位為/mol。亞佛加德羅常數可用多種實驗方法測得,到目前為止測得比較精確的數據是6.0221367×10²³ mol⁻¹,這個數值還會隨測定技術的發展而改變。把每摩爾物質含有的微粒數定為亞佛加德羅常數,而不是說含有6.02×10²³個微粒。在定義中引用實驗測得的數據是不妥當的,不要在概念中簡單地以6.02×10²³來代替“亞佛加德羅常數” 。
一般用途
亞佛加德羅常數是一個比例因子,聯繫自然中巨觀與微觀(原子尺度)的觀測。它本身就為其他常數及性質提供了關係式。例如,它確立了氣體常數 R與玻耳茲曼常數 k間的關係式,
以及法拉第常數 F與基本電荷 e的關係式,
同時,亞佛加德羅常數是原子質量單位( u)定義的一部份,
其中 M為摩爾質量常數(即國際單位制下的1g/mol) 。
衡量方法
 阿伏伽德羅常數
阿伏伽德羅常數亞佛加德羅常數是有量綱的,就是那么一堆東西,那么多粒子就叫1mol。 摩爾就是“一堆”古希臘叫做“堆量”。那么一堆數量就叫一摩爾,它是物質的量的單位,說白了就是粒子“堆”數的單位。相對分子質量的單位是1,當摩爾質量以克每摩爾為單位時,兩者數值上相等。
方法一
摩爾是表示物質的量的單位,每摩爾物質含有亞佛加德羅常數個微粒。摩爾是國際單位制中的基本單位之一,用於表示物質的量,簡稱摩,符號為mol。1971年第十四屆國際計量大會規定:“摩爾是一系統的物質的量,該系統中所包含的基本單元數與0.012kg¹²C的原子數目相等。使用摩爾時應予以指明基本單元,它可以是原子、分子、離子、電子及其他粒子,或是這些粒子的特定組合。”摩爾好似一座橋樑把單個的、肉眼看不見的微粒跟大數量的微粒集體、可稱量的物質之間聯繫起來了。在化學計算中套用摩爾十分方便。
方法二
亞佛加德羅常數,0.012kg¹²C中所含的原子數目叫做亞佛加德羅常數。亞佛加德羅常數的符號為 N。亞佛加德羅常數的近似值為:6.02×10²³/mol。
符號: N
含義:1mol任何粒子所含的粒子數均為亞佛加德羅常數 。