產生原因
 丁達爾現象
丁達爾現象所以說,膠體能有丁達爾現象,而溶液幾乎沒有,可以採用丁達爾現象來區分膠體和溶液,注意:當有光線通過懸濁液時有時也會出現光路,但是由於懸濁液中的顆粒對光線的阻礙過大,使得產生的光路很短。
試驗例證
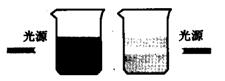 |
| CuSO4溶液Fe(OH)3溶膠 |
1869年,丁達爾發現,若令一束匯聚的光通過溶膠,則從側面(即與光束垂直的方向)可以看到一個發光的圓錐體,這就是丁達爾效應。
其他分散系統產生的這種現象遠不如溶膠顯著,因此,丁達爾效應實際上成為判別溶膠與真溶液的最簡便的方法。如圖所示為Fe(OH)3溶膠與CuSO4溶液的區別。
可見光的波長約在400~700nm之間,當光線射入分散系統時,一部分自由地通過,一部分被吸收、反射或散射,可能發生以下三種情況:
(1)當光束通過粗分散系統,由於分散相的粒子大於入射光的波長,主要發生反射或折射現象,使系統呈現混濁。
(2)當光速通過膠體溶液,由於分散相粒子的半徑一般在1~100nm之間,小於入射光的波長,主要發生散射,可以看見乳白色的光柱,出現丁達爾現象。
(3)當光束通過分子溶液,由於溶液十分均勻,散射光因相互干涉而完全抵消,看不見散射光
膠體中的丁達爾現象
1869年,英國科學家丁達爾發現了丁達爾現象。
丁達爾現象是膠體中分散質微粒對可見光(波長為400~700nm)散射而形成的。它在實驗室里可用於膠體與溶液的鑑別。
光射到微粒上可以發生兩種情況,一是當微粒直徑大於入射光波長很多倍時,發生光的反射;二是微粒直徑小於入射光的波長時,發生光的散射,散射出來的光稱為乳光。
散射光的強度,隨著顆粒半徑增加而變化。懸(乳)濁液分散質微粒直徑太大,對於入射光只有反射而不散射;溶液里溶質微粒太小,對於入射光散射很微弱,觀察不到丁達爾現象;只有溶膠才有比較明顯的乳光,這時微粒好像一個發光體,無數發光體散射結果,就形成了光的通路。
散射光的強度,還隨著微粒濃度增大而增加,因此進行實驗時,溶膠濃度不要太稀。
 |
| 日落之光丁達爾現象 |
樹林中的丁達爾現象
清晨,在茂密的樹林中,常常可以看到從枝葉間透過的一道道光柱,類似於這種自然界現象,也是丁達爾現象。這是因為雲、霧、煙塵也是膠體,只是這些膠體的分散劑是空氣,分散質是微小的塵埃或液滴。 |
| 清晨,在茂密的樹林 |
