Tollens試劑
硝酸銀的氨水溶液。化學式: Ag(NH)OH。
性質:可將醛氧化為羧酸,並產生金屬銀沉積於玻璃反應器皿壁上(銀鏡),常用於製作瓶膽和鑑別還原糖。用於鑑別醛基,而羰基則不反應。該試劑應現配現用,不宜保存。
配製方法
1、準備試管:在試管里先注入少量氫氧化鈉溶液,振盪,然後加熱煮沸。把氫氧化鈉倒去後,再用蒸餾水洗淨備用。
2、配製溶液:往潔淨的試管中加入1mL2%硝酸銀溶液,然後邊振盪邊逐滴滴入2%稀氨水,邊滴邊振盪,直到最初產生的的沉澱剛好溶解為止。
向溶液里逐滴滴加氨水首先析出AgOH:
AgNO+NH·HO=AgOH↓+NHNO
常溫下AgOH極不穩定,分解為AgO暗棕色沉澱。
2AgOH=AgO+HO
繼續滴加氨水,沉澱溶解:
AgO+4NH·HO=2Ag(NH) +2OH +3HO
同時,生成的OH 與前面反應生成的NH 反應:
OH +NH =NH·HO
因此,向AgNO溶液里加入稀氨水至沉澱溶解的總離子方程式為:
Ag +2NH·HO=Ag(NH) +2HO。此時溶液中只含NO 和Ag(NH)
即得到Ag(NH)NO,不是氫氧化二氨合銀。
銀鏡反應
在潔淨的試管里加入1mL2%的硝酸銀溶液,再加入氫氧化鈉水溶液,然後一邊振盪試管,可以看到白色沉澱。再一邊逐滴滴入2%的稀氨水,直到最初產生的沉澱恰好溶解為止(這時得到的溶液叫銀氨溶液)。
葡萄糖、乙醛的銀鏡反應:再滴入一滴管的葡萄糖溶液或3滴乙醛,振盪後把試管放在熱水中溫熱。不久可以看到,試管內壁上附著一層光亮如鏡的金屬銀(在此過程中,不要晃動試管,否則只會看到黑色沉澱而無銀鏡)。
反應本質:這個反應里,硝酸銀與氨水生成的銀氨溶液中含有氫氧化二氨合銀,這是一種弱氧化劑,它能把乙醛氧化成乙酸(即-CHO被氧化成-COOH),乙酸又與生成的氨氣反應生成乙酸銨,而銀離子被還原成金屬銀。從葡萄糖的角度來說,葡萄糖中有醛基,具有還原性,把硝酸銀里的銀離子還原成金屬銀。
注意事項
1、銀鏡反應的成敗關鍵之一,是所用的儀器是否潔淨。
2、配製銀氨溶液時,應防止加入過量的氨水。銀氨溶液必須隨配隨用,不可久置。
3、實驗完畢,試管內的銀氨溶液要及時處理,先加入少量鹽酸,倒去混和液後,再用少量稀硝酸洗去銀鏡,並用水洗淨。否則可能會生成雷爆銀(主要成分是氮化銀)。
果糖的Tollens試劑反應
糖類物質的研究距今已有一百多年的歷史,隨著糖類物質在生命科學領域重大作用的發現,糖類性質的研究日益成為研究者關注的焦點之一。但在現行眾多的有機化學論著中,對葡萄糖、果糖這兩個重要的單糖與Toflens試劑等弱鹼性氧化劑反應的實驗現象,沒有給出合理解釋。
在糖類物質性質中,用弱鹼性氧劑(Tollens試劑、Fehling試劑、Benediet試劑)檢出還原糖是實驗的重要內容,而果糖在這些實驗中,均比葡萄糖活潑,這與醛比酮更易氧化的規律不符,按目前較權威的解釋,認為,果糖能被這些弱氧化劑氧化,是因為在鹼性條件下,酮基不斷地轉變為醛基。這雖然說明了果糖能弱鹼性氧化劑氧化的原因,但不能解釋果糖與其反應速率比葡萄糖快。既然果糖要異構化為醛糖後方能與弱鹼性氧化劑作用,那么它的反應速率理應比醛糖慢,這與實驗事實不符。
Singh MP等人曾用紫外光譜和同位素追蹤等手段對還原糖與Tollens試劑等弱氧化劑反應的動力學進行了研究,以Tollens試劑氧化單糖為例,反應機理可以表示為:總反應速率方程為:V=K1[S][OH ]。
在鹼及單糖濃度相同時,其反應速率決定於單糖形成烯二醇負離子這一步,即烯醇化速率決定整個氧化過程的快慢,對果糖與葡萄糖在鹼性條件下烯醇化速率的測定己有報導,果糖烯醇化速率是葡萄糖烯醇化速率的11.3倍,說明這即是果糖較葡萄糖與弱氧化劑反應更快的關鍵。
那么葡萄糖烯醇化的速率為什麼較果糖慢呢?DeWitG等人研究表明糖的烯醇化是糖分子內質子轉移的過程。如葡萄糖烯醇化是α-C(C1)上的氫轉移到毗喃果糖的環內氧上,與羰基化合物烯醇化相似,據此有人提出如下烯醇化歷程:
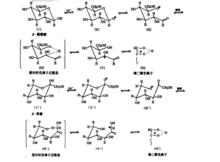 烯醇化歷程
烯醇化歷程在該歷程中,決定速率的步驟為假環狀負離子過渡態的形成,認為果糖反應比較快有兩個原因:
①果糖中可遷移的α-H有兩個(C1上的氫),而葡萄糖為一個(C2上的H),遷移幾率果糖大於葡萄糖;
②形成假環狀負離子時,果糖C1-C2的旋轉較葡萄糖C2-C3的旋轉容易,且α-H與負離子間較鄰近。
總之,果糖能與Tollesn試劑等弱氧化劑反應且速度較葡萄糖快,原因是酮糖和醛糖一樣,與弱氧化劑反應首先要形成烯二醇負離子,果糖之所以快於葡萄糖是因為其形成烯二醇負離子的速率快,造成的原因是(1)OH 進攻α-H的難易程度;(2)生成烯二醇負離子的穩定性。

