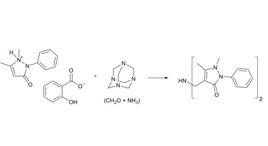
概述
反應中的胺一般為二級胺,如哌啶、二甲胺等。如果用一級胺,反應後的縮合產物在氮上還有氫,可以繼續發生反應,故有時也可根據需要使用一級胺,一級胺與甲醛常溫下會迅速脫水,形成希夫鹼。如果用三級胺或芳香胺,反應中無法生成亞胺離子,停留在季銨離子一步。
胺/氨的作用是活化另一個反應物醛。甲醛是最常用的醛,一般用它的水溶液、三聚甲醛或多聚甲醛。除甲醛外,也可用其他醛。反應一般在水、乙酸或醇中進行,加入少量鹽酸以保證酸性。
含α-氫的化合物一般為羰基化合物(醛、酮、羧酸、酯)、腈、脂肪硝基化合物、末端炔烴、α-烷基吡啶或亞胺等。若用不對稱的酮,則產物是混合物。呋喃、吡咯、噻吩等雜環化合物也可反應。
曼氏反應通常需在高溫下和質子溶劑中進行,反應時間長,容易生成副產物。
反應機理
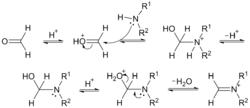 反應機理
反應機理反應的機理如下圖所示。羰基質子化,胺對羰基發生親核加成,去質子,氮上的電子轉移,水離去,可以得到一個亞胺離子中間體。以二甲胺作原料,這箇中間體為 N, N-二甲基-亞甲基氯化銨,在70年代由Kinact等人首先發現。它具有很強的反應性,可以使很多在通常條件下難以進行的反應得以順利進行。
亞胺離子作為親電試劑,進攻含活潑氫化合物的烯醇型結構,失去質子,便得到產物。
產物曼氏鹼比較穩定,以它作原料,經甲基化與Hofmann消除反應,或在蒸餾時和鹼作用下發生的分解反應,可以得到α,β-不飽和酮。後者可以與親核試劑發生麥可加成等反應,是很有用的合成前體,但由於它一般不穩定,容易聚合,故通常採用曼氏鹼分解生成不飽和酮,並使其在原位與其它試劑發生反應。
醛、酮等具有活潑α-H的化合物(酸、酯、硝基化合物、氰基化合物、末端炔烴…)與甲醛、胺(一級胺、二級胺或氨)在乙醇溶液中回流,使酮的α-H被胺甲基取代。該反應也稱為胺甲基化反應,所得產物成為曼尼希(Mannich)鹼。參見
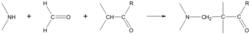 曼尼希反應
曼尼希反應發展歷史
早在1895年便有人發現以酚作酸組分的曼尼希鹼,並申請了專利。之後,Tollens、L. Henry、Duden、Franchimont等人發現了其他類型的曼尼希反應,包括以硝基烷和伯硝胺作酸組分的反應,但都沒有意識到這些反應所具有的普遍意義。1912年,卡爾·曼尼希用沙利比林和烏洛托品反應,得到了一個難溶於水的沉澱。此產物的結構在一年內得到了解釋, 促使了他對這一類含活潑氫化合物、甲醛和胺之間的反應進行了深入的研究,從而奠定了曼尼希反應的基礎。很多生物鹼都是通過曼尼希反應合成的。
托品酮的合成是曼尼希反應的經典例子,被認為是全合成中的經典反應之一。1901年,Willstätter首先合成了這個化合物,用的是環庚酮作原料,通過14步反應,總產率僅為0.75%。1917年,羅伯特·魯賓遜以丁二醛、甲胺和3-氧代戊二酸為原料,在仿生條件下,利用了曼尼希反應,僅通過一步反應便得到了托品酮。反應的初始產率為17%,後經改進可增至90%。
套用
1.含氮雜環的合成,如托品酮
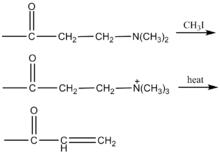 曼尼希反應
曼尼希反應2.在指定碳上引入雙鍵:生成的曼尼希鹼與碘甲烷作用得到季銨鹽,後者經熱消除形成不飽和鍵。
反應的立體選擇性
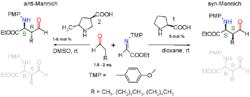 不對稱曼尼希反應
不對稱曼尼希反應曼尼希反應會產生兩個原手性碳原子,因此產物是兩對對映異構體。可以經過手性誘導,使反應生成立體選擇性的產物。2002年List等人發現,在環己酮、甲醛、苯環上連有各種取代基的苯胺之間進行的曼尼希反應中,加入脯氨酸作為催化劑之後,得到的產物則能達到98% ee的立體選擇性,反應如圖。