簡介
 重排反應
重排反應酮肟在酸性條件下發生重排生成N-烴基醯胺的反應。1886年由德國化學家E.O.貝克曼首先發現。常用的貝克曼重排試劑有硫酸、五氯化磷、貝克曼試劑(氯化氫在乙酸-乙酐中的溶液)、多聚磷酸和某些醯鹵等。反應時酮肟受酸性試劑作用,形成一個缺電子氮原子,同時促使其鄰位碳原子上的一個烴基向它作分子內 1,2-遷移,其反應過程如下:
貝克曼重排是立體專一性反應。在酮肟分子中發生遷移的烴基與離去基團(羥基)互為反位。在遷移過程中遷移碳原子的構型保持不變,例如:
 重排方程式
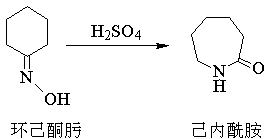
重排方程式貝克曼重排反應可用於確定酮類化合物的結構。工業上利用環己酮肟發生貝克曼重排,製備大量己內醯胺,它是合成耐綸6(見聚己內醯胺)的單體。
反應歷程
酮肟在酸性催化劑如硫酸、五氯化磷等作用下重排成取代醯胺的反應,稱為Beckmann(貝克曼)重排反應。
Beckmann重排反應是最著名的由C→N的重排,其重排特點不在於遷移基團的性質,例如相對的供電子能力(如前面討論過的重排),而是決定於它們的立體化學排列,即在不對稱酮肟的重排過程中只有與羥基處於反位的基團才能遷移到氮上(反式重排),並且遷移基團從離去基(HO)的背面經橋式中間體通過協同反應實現重排的。其反應歷程可表示如下:
 反應歷程
反應歷程實驗證明,在Beckmann重排反應中遷移基團具有手性時,其構型在重排過程中保持不變。這說明Beckmann重排是分子內的由C→N的重排反應,即遷移基團並未完全脫離整個分子(否則將有外消旋化合物生成)。
重排機理
貝克曼(Beckmann)重排是指在酸性條件下,醛肟或酮肟的肟羥基質子化成易離去基團,然後與肟羥基反位的鄰近基團遷移,同時離去基團離去,產生鄰碳的正中心,繼而與反應介質中的親核試劑(如水)發生水合、脫質子化生成亞胺,再烯醇式-酮式互變而生成N-取代的醯胺。在重排中氮氧鍵的斷裂與反位基團的遷移是同步發生的。
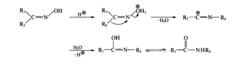 重排機理
重排機理Beckmann重排影響因素
Beckmann重排中,催化劑、反應溫度及溶劑對反應速度、收率、醯胺異構體的比例有很大影響,一般來說,極性溶劑和較高的溫度都能加速反應。重排反應是一級反應,所以極性溶劑可加快反應進行,溶劑的極性愈強,重排反應進行得愈快。反應介質的酸度與重排反應的速度也有關係,酸性越強,肟酯越易離去負離子,因而重排速度越快。
1.酸性條件和溶劑作用
酸性試劑的作用是使酮肟的羥基轉換成活性很好的離去基團,有利於氮氧鍵的斷裂。歸納起來,常見的酸性試劑有以下幾類。
(1)無機質子酸類:HSO,HCl,PPA。
(2)有機酸類:三氟磺酸,乙酸。
(3)Lewis酸類:BF,AlCl,ZnCl,HgCl。
(4)氯化劑或醯氯類:SOCl,PCI,PhSOCl,POCl。
(5)混合試劑類:PhP-CCl,HPO-AcO。
(6)其他類:Zeolite-α,Zeolite-β。
例如在室溫條件,二苯酮肟與苯磺醯氯在吡啶催化下,得到N-苯磺醯基苯甲醯苯胺,最後得到醯胺;又有最新報導在HgCl催化下,也可得到相同的重排產物:
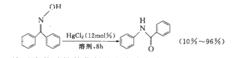 重排反應
重排反應2.酮肟的結構
由於醛肟在重排條件下易失水形成腈,所以一般不採用醛肟製備甲醯胺。在酮肟的結構中若含有酸敏感的基團,可以吡啶(或三乙胺)為溶劑,以醯氯或Lewis酸為催化劑進行重排反應。脂環酮肟進行重排發生擴環反應,生成內醯胺結構。
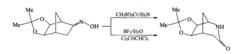 脂環酮肟的重排反應
脂環酮肟的重排反應此外,轉移基團上的取代基的性質對重排反應速度也有影響,吸電子基團的存在使重排速度降低,而推電子基團的存在則使重排速度加快。
3.Beckmann重排立體化學特徵
(1)烴基的遷移是立體專一的。由於遷移的基團只能從羥基背面進攻缺電子的N原子,因此,烴基的遷移為反位遷移。因酮肟有順式(Z)和反式(E)兩種幾何異構,由上述貝克曼重排機理可見,與氮上的羥基處於反位的烴基遷移占優勢。但當以質子酸作催化劑時,遷移往往不具有立體專一性。
(2)如果遷移基團為手性碳原子,其遷移後的手性在重排中不受影響,仍保留原有構型。
Beckmann重排在藥物合成中的套用
由於Beckmann重排的原子轉化率高達100%,所以它屬於原子間經濟性的反應。目前,該反應已較多地套用於藥物合成中,成為綠色化學的反應類型之一。
1.合成醯胺類藥物及藥物中間體
通過Beckmann重排反應可以達到在藥物分子中引入醯胺結構的目的,以延長藥物的作用時間、減小藥物毒性等。
例如苯酚經過乙醯化、肟化和Beckmann重排反應可合成撲熱息痛。先用HF催化苯酚和乙酸酐的乙醯化,再與羥胺硫酸鹽進行肟化反應,所得酮肟在SOCl催化下,在乙酸乙酯溶劑中進行Beckmann重排反應,得目標產物N-乙醯基-對氨基苯酚。重排反應時加入少量的KI是為抑制副反應。
2.合成芳胺類藥物
套用Beckmann重排反應能以較高收率合成某些難製取的芳胺。例如,去氫松香酸甲酯因在溫和條件下可進行硝化,得6,8-二硝基化合物,因此不能經芳環硝化再還原引入—NH。但若採用Friedel-Crafts醯基化反應,則得到的幾乎完全是6-乙醯基衍生物。該衍生物在吡啶中與NHOH ·HCl反應得酮肟,再經Beckmann重排可生成88%的乙醯芳胺ArNH-COCH。(只有約4%的ArCONHCH),水解後即可得芳胺。
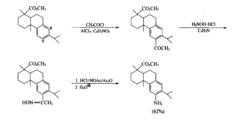 芳胺類藥物合成
芳胺類藥物合成