簡介
 革蘭氏陽性細菌
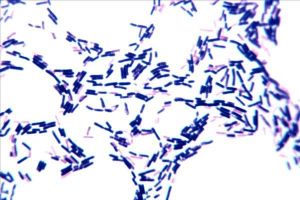
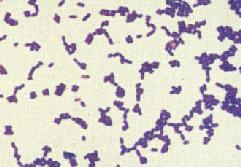
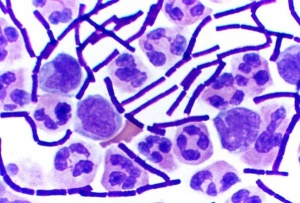
革蘭氏陽性細菌革蘭氏陽性菌包含細菌中的一個大門——厚壁菌門(Firmicutes),包括一些著名的屬,如芽孢桿菌(Bacillus)、李斯特氏菌(Listeria)、葡萄球菌(Staphylococcus)、鏈球菌(Streptococcus)、腸球菌(Enterococcus)和梭菌(Clostridium)。此外厚壁菌門還包括了柔膜菌綱(Mollicutes),如支原體(Mycoplasma),它們不能被革蘭氏法染色,但與這些革蘭氏陽性種類相關。
 革蘭氏陽性細菌
革蘭氏陽性細菌此外,儘管恐球菌-棲熱菌(Deinococcus-Thermus)類細菌結構上類似革蘭氏陰性菌,但也可被染成革蘭氏陽性。
革蘭氏染色法,能夠把細菌分為兩大類:採用這種染色方法,是先用龍膽紫(亦稱結晶紫)來染病菌,所有細菌都染成了紫色,然後再塗以革蘭氏碘液,來加強染料與菌體的結合,再用95%的酒精來脫色20~30秒鐘,有些細菌不被脫色,仍保留紫色,有些細菌被脫色變成無色,最後再用復紅或沙黃復染1分鐘,結果已被脫色的細菌被染成紅色,未脫色的細菌仍然保持紫色,不再著色,這樣,凡被染成紫色的細菌稱為革蘭氏陽性菌(G﹢菌);染成紅色的稱為革蘭氏陰性菌(Gˉ菌)。革蘭氏染色法的意義就在於鑑別細菌,把眾多的細菌分為兩大類,革蘭氏陽
 革蘭氏陽性細菌
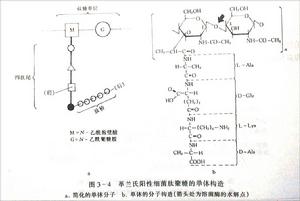
革蘭氏陽性細菌革蘭氏染色的結果取決於細菌細胞壁的結構即革蘭氏染色原理為:
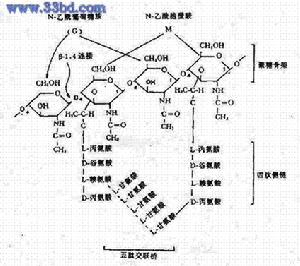
G﹢菌:細胞壁厚,肽聚糖網狀分子形成一種透性障,當乙醇脫色時,肽聚糖脫水而孔障縮小,故保留結晶紫-碘複合物在細胞膜上。呈紫色。
Gˉ菌:肽聚糖層薄,交聯鬆散,乙醇脫色不能使其結構收縮,其脂含量高,乙醇將脂溶解,縫隙加大,結晶紫-碘複合物溶出細胞壁,沙黃復染後呈紅色。
高耐藥率
隨著抗生素濫用現象不斷加劇,臨床細菌耐藥問題日趨嚴重。在近日閉幕的“抗生素治療革蘭氏陽性細菌現狀與進展學術研討會”上,張致平、朱士俊、羅慰慈等專家再次發出警示。
 革蘭氏陽性細菌
革蘭氏陽性細菌北京大學臨床藥理研究所副所長肖永紅教授認為,目前,我國此類感染以耐甲氧西林葡萄球菌、耐環大內酯肺炎鏈球菌、耐青黴素肺炎鏈球菌為主,比例均達70%以上。對此,大部分抗生素已失去效用。更令人擔憂的是,我國學者已從動物肌肉內分離到耐萬古黴素腸球菌。
專家指出,在加緊研發新治療藥物的同時,必須大力摒除臨床上不對症套用、長時間套用抗生素,以及在動物飼料中大量添加抗生素等行為。
表面呈現系統
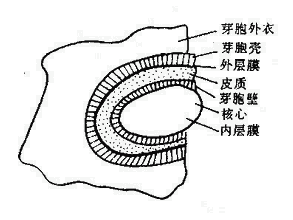
細菌表面呈現系統是微生物表面呈現系統的一個重要分支,它是繼噬菌體表面呈現系統之後發展起來的又一呈現
 革蘭氏陽性細菌
革蘭氏陽性細菌自從發現大腸桿菌外膜蛋LamB、OmpA和PhoE能夠作為外源蛋白的表面呈現載體以來,該技術得到了迅猛發展,許多研究結果說明脂蛋白、菌毛蛋白、鞭毛蛋白等都可作為呈現載體。而且不僅革蘭氏陰性菌可用以表面呈現,革蘭氏陽性菌也可用以表面呈現。該技術已成為研究的熱點,在微生物學、分子生物學、疫苗學等多個領域的基礎和套用研究中得到了廣泛套用。
革蘭氏陽性菌胞膜外有一層較厚且堅韌的細胞壁,膜蛋白難以顯露,一般認為不適合表面呈現。但最近的一些研究發現有些細胞表面結合蛋白,如金黃色葡萄球菌蛋白A、化膿鏈球菌M6蛋白等的C末端具有較高的同源性,可以通過一段疏水區與含肽聚糖的細胞壁結合而錨定於細菌表面,而其N末端部分則允許外源蛋白的插入或替換,從而實現表面呈現。通過對spA透膜錨定機制的研究發現,spA由信號肽、lgG結合區和C末端的表面結合區組成,而其C末端結合區由一個帶電的重複序列區、許多革蘭氏陽性菌表面結合蛋白相同的含有LPXTG結構的區段、疏水的錨定區和一個短的帶電尾巴RREL組成,後三部分對於結合在細菌表面是必須的,伴隨著LPXTG結構中T-G間肽鍵的斷裂而共價結合到細胞壁上。
 革蘭氏陽性細菌
革蘭氏陽性細菌用該系統成功呈現了螺鏇體外膜蛋白A(OspA),用重組菌去免疫小鼠,所誘發的免疫應答水平明顯高於用BCG胞質表達OspA或分泌表達的融合蛋白免疫所誘發的免疫應答水平,抗體效價比可高達100-1000倍。提示表面呈現蛋白的免疫提呈方式可能不同於一般的抗原,效率更高,再者脂蛋白的免疫佐劑作用也利於誘發高水平的免疫應答。球桿菌也被用於表面呈現的研究,在該系統中是將外源蛋白與細胞壁結合的自溶素修飾蛋白CwbA融合而獲表面呈現,用呈現的偽結核病耶氏菌侵襲素免疫動物,可以誘發特異的抗體反應。在乳球菌中,嘗試將破傷風毒素與細胞表面結合的蛋白酶PrtP融合進行呈現,但沒有獲得成功。