基本性質
從量子力學觀點來看,電子可以出現在原子內任何位置上。也就是說,外層電子可以鑽人內部殼層而更靠近原子核,從而削弱了內層電子的禁止效用,相對增加了原子的有效核電荷,使得原子軌道的能級降低,這種現象稱為鑽穿效應。鑽穿效應越大,意味著電子可以出現在離核近一些的區域,電子的能量越低。
定性判斷
鑽穿效應的大小可以根據核外電子云的徑向分布函式進行定性判斷:
主量子數n相同而角量子數l不同的軌道,能級的順序是:E<E<E<E,這種現象叫作能級分裂。這是因為主量子數相同的各態中,s態峰的數目最多,它的分布特點是:主峰離核最遠,小峰靠核最近,隨著核電荷的增加,最靠近核的小峰在能量上的作用越來越明顯。這一方面是小峰所代表的電子云有效地避開其他電子的禁止,作廂在小峰上的有效核電荷大;另一方面,小峰所代表的電子云離核近。兩個因素都使電子和原子核的相互作用能增加,對該軌道的能級降低影響較大。
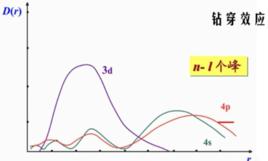
對於n和l都不同的軌道,n值大的電子亞層能級反而比n值小的電子亞層能級低,例如E<E,這種現象稱為能級交錯。、能級交錯也可以用鑽穿效應來說明,通過把4s和3d的徑向分布函式圖進行比較可以看出(如下圖):
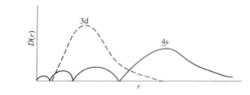 4s和3d的徑向分布函式
4s和3d的徑向分布函式4s最大峰雖然比3d離核要遠,但是它有小峰很靠近核。因此,4s比3d鑽穿能力要大。4s和3d的徑向分布函式圖時也更好地迴避其他電子的禁止。結果4s電子雖然主量子數較3d大,但角量子數小,鑽穿效應大,使得4s軌道能級低於3d軌道的能級,即E4s<E3d。其他能級次序的不規則排列,如E<E,E<E< E,大體上都可以用同樣的原因予以說明。