簡介
鍵級最初為衡量化學鍵強度的參量被引出。指鍵合兩原子形成化學鍵的重數,經典有機化學理論把鍵級只取做整數。特點
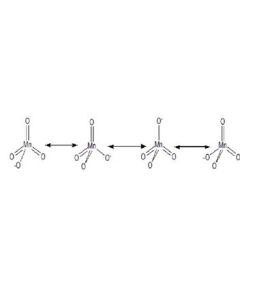 鍵級
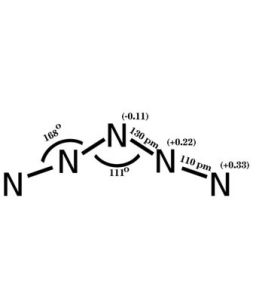
鍵級對於離域π鍵,相鄰原子i和j之間的π鍵鍵級為:其中nk是第k個分子軌道中的π電子數,Cki和Ckj分別是第k個分子軌道中i和j的原子軌道的組合係數。例如,烯丙基陽離子的2個π電了占據ψ1,。
鍵級=(穩定結構的電子總數-價電子總數)/2 (更方便計算)
鍵級=(成鍵軌道電子數-反鍵軌道電子數)/2
鍵級,指的是描述分子中相鄰原子之間的成鍵強度的物理量,鍵級最初為衡量化學鍵強度的參量被引出。
 鍵級
鍵級能表征化學鍵性質的物理量稱為鍵參數(bond parameter)。
鍵參數 鍵能 鍵長 鍵角 鍵的極性王鍵自幼因小兒麻痹症造成重度殘疾。他從1993年開始練習舉重,是2004年雅典殘奧會男子舉重56公斤級比賽金牌獲得者,也曾是該級別世界紀錄的保持者。
個人簡介 個人榮譽英雄級武器是騰訊遊戲《穿越火線》中武器的一類,特點是自己和同房間的玩家經驗加成,GP(遊戲幣)加成,戰績自定義保存、創建房間特殊“V”表示等,同類武器子...
介紹 爭議事件 英雄級道具 夢幻級道具 命運級道具雙排鍵,起源於管風琴;因演奏方式與管風琴相似而得名。著名器樂演唱組合玖月奇蹟的出現,讓雙排鍵走進了大眾的視野。雙排鍵,具有近千種音色,音質接近真實樂器。...
基本構造 發展歷程 主要差別 雙排鍵演奏 有關院校雙排鍵電子琴(電子管風琴),起源於管風琴。管風琴是大型鍵盤樂器,結構非常複雜。管風琴有手鍵盤和腳鍵盤構成,有些手鍵盤多達4-5層。一架管風琴的演奏可以和...
簡介 相關院校 相關信息鍵強度是一個專業術語,用來描述化學鍵的強弱。
深圳鍵橋通訊技術股份有限公司 是專業從事專網通訊技術解決方案的服務商,多年來致力於為電力、城市交通、軌道交通、煤炭、石油等系統的企業提供專網通訊技術解決...
公司簡介 企業文化 公司願景 企業精神高鍵,男,漢族,1969年10月生,山西稷山人,大學學歷,文學碩士學位,1991年1月加入中國共產黨,1992年10月參加工作。現任山西省朔州市委副書記、市長。
人物履歷 任免信息