定義
電子數,就是電子的數量。電子是一種基本粒子
在化學中,電子數一般是指原子或離子的核外電子的數目。
性質
物質的某些性質是由其微觀結構決定的(“四決定”):
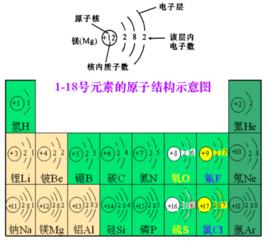
1.最外層的電子數決定元素的化學性質。如:稀有氣體原子的最外層電子數達到穩定結構,其化學性質穩定,金屬和非金屬原子的最外層電子數沒有達到穩定結構,故它們的化學性質活潑。
2.最外層電子數決定元素的最高正價或最低負價。如硫的最外層電子數為6,其最高正價為+6,最低負價為-2.
3.核內質子數決定元素的種類,如質子數為13的元素為鋁元素。
4.中子數影響元素的相對原子質量(相對原子質量=質子數+中子數)。如鈉的質子數為11,中子數為12,則鈉的相對原子質量為23。
計算
原子的核外電子數=原子序數=核內質子數=核電荷數(離子的核外電子數=原子序數(之和)-所帶電荷數)
排布規律
各電子層最多容納的電子數目是2n^2(n為電子層序數)。最外層電子數目不超過8個(K層為最外層時不超過2個)。次外層電子數目不超過18個,倒數第三層電子數目不超過32個。核外電子總是儘先排布在能量最低的電子層里,然後再由里向外,排滿了L層才排M層。以上四條規律是相互聯繫的,不能孤立地理解。
| 電子層序數 | 電子層符號 |
| 1 | K |
| 2 | L |
| 3 | M |
| 4 | N |
| 5 | O |
| 6 | P |
| 7 | Q |
電子能量
電子離核由近到遠,電子能量由低到高