數值定義
一種酸的p K越大則酸性越弱,p Ka越小則酸性越強。p K<0(一說為p K<-1.76,即水合氫離子的p K)的酸在水中是強酸,介於0與4.0之間為中強酸,其他為弱酸 。
影響因素
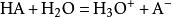 酸度係數
酸度係數酸的電離反應通式為: 。
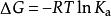 酸度係數
酸度係數因此酸的p K反映的是酸經由質子傳遞,轉化為水合氫離子與共軛鹼的難易程度 ,這個程度由化學熱力學過程決定,由公式 可計算出p K的值。
從定性角度分析,則可以通過下面的理論粗略比較酸中鍵能大小判斷酸的酸性強弱:
在含氧酸中,中心原子所連線的非羥基氧(或氟,氯等電負性大的元素)越多,則-OH基團中電子云密度越小,氫越容易電離出。例如,高氯酸(三個非羥基氧)的酸性比氯酸(兩個非羥基氧)強 。
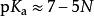 酸度係數
酸度係數結合上面的理論,使用鮑林規則可以半定量地判斷含氧酸的p K,其理論是:多元含氧酸逐級電離常數之比約為10 ,即p K差值為5;含氧酸的p K與非羥基氧數量(N)有關, 。由此可判斷,無非羥基氧的酸為弱酸,有一個的為中強酸,兩個或三個的為強酸 。
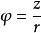 酸度係數
酸度係數含氧酸的中心原子R對其酸性有著重要影響,R的半徑越小,電負性越大,氧化數越高,則R吸引電子的能力越強,降低了-OH上的電子云密度,使其容易電離。這個規則稱為R-O-H規則 。使用離子勢可以半定量地判斷含氧酸的酸性大小,其計算公式為 ,其中 z為中心陽離子電荷, r為中心陽離子半徑。離子勢反映了中心原子的極化作用強弱,離子勢越高,酸性越強 。
對於非含氧酸,可以結合HSAB理論進行理解。在HSAB中,氫離子是極硬的酸,因此與其結合的鹼越軟,則它們的鍵能越小,越容易電離。例如,氟離子為硬鹼,碘離子為軟鹼,因此氟化氫的酸性遠小於碘化氫 。
分子的異構現象亦可對p K造成影響 。例如反丁烯二酸與順丁烯二酸的分子結構幾乎完全相同,只是前者為反式結構,後者為順式結構。順丁烯二酸在一級電離時由於形成氫鍵,而使它比反丁烯二酸容易電離,二級電離時由於破壞氫鍵,使得它比反丁烯二酸難電離。
氫鍵也會對p K有一定影響,例如前面所提到的氟化氫,其成為弱酸的原因不僅在於H-F鍵能相對較大,還在於其電離後由氫鍵形成了穩定的離子對,不能完全發揮出酸的作用。
區別聯繫
在水溶液中由於酸及其共軛鹼的電離作用就等同於水的自我離子化,酸度係數與鹼度係數(p K)的和就相等於水的離解常數(p K),在25℃下p K+p K=p K=14 。
由於 K與 K的積是一常數,較強的酸即代表較弱的共軛鹼;較弱的酸,則代表較強的共軛鹼 。
套用
•判斷質子溶劑中酸鹼反應的方向與程度 ,如強酸制弱酸,弱酸制更弱酸等。
•判斷一種質子酸(可以電離出H的酸)在一種質子溶劑(可結合H的溶劑)中是否電離完全。若一種酸的pK小於溶劑化質子(溶劑的共軛酸)的pK,則這種酸在此溶液中可以視作完全電離。
•計算酸溶液的pH值、共軛鹼的強度等 。
•計算出緩衝溶液的pH值 ,在亨德森-哈塞爾巴爾赫方程亦可得出以上結論。
緩衝溶液
緩衝溶液由弱酸HA與其酸根離子A 共同構成,其一大特點是,在被稀釋或加入少量強酸/強鹼時,其pH值幾乎不變。酸度係數可實現緩衝溶液的相關計算 :
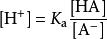 酸度係數
酸度係數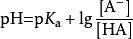 酸度係數
酸度係數設緩衝系統中HA的電離常數為 K(平衡常數),則由弱酸的電離平衡式可得下式: ; ,這就是亨德森-哈塞爾巴爾赫(Henderson-Hasselbach)方程。
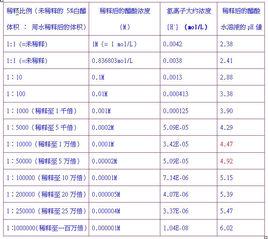
如果緩衝溶液中弱酸濃度與其酸根離子濃度相等,則:pH=p K,由此可看出,緩衝溶液的pH值不受稀釋所影響,然而這個結論是在忽略水的電離下得出的,如果稀釋足夠倍數,其最終結果仍是趨於pH=7。由此公式,可通過滴定來測量弱酸的酸度係數:將弱酸恰好中和至一半,此時溶液的pH即為弱酸的p K。
根據此式可得出下列幾點結論:
緩衝液的pH值與該酸的電離平衡常數K及鹽和酸的濃度有關。弱酸的pK值衡定,但酸和鹽的比例不同時,就會得到不同的pH值。
酸和鹽濃度等比例增減時,溶液的pH值不變;
酸和鹽濃度相等時,緩衝液的緩衝效率為最高,比例相差越大,緩衝效率越低,緩衝液的一般有效緩衝範圍為pH=pK±1,pOH=pK±1。
1.緩衝液的pH值與該酸的電離平衡常數K及鹽和酸的濃度有關。弱酸的pK值衡定,但酸和鹽的比例不同時,就會得到不同的pH值。
2.酸和鹽濃度等比例增減時,溶液的pH值不變;
3.酸和鹽濃度相等時,緩衝液的緩衝效率為最高,比例相差越大,緩衝效率越低,緩衝液的一般有效緩衝範圍為pH=pK±1,pOH=pK±1。
生物化學
由於蛋白質及胺基酸均具有酸鹼的性質,因此在生物化學中,pK被用於生理機能的研究。例如,蛋白質及其胺基酸側鏈對酶的活性及蛋白質的穩定性具有重要影響 。
數值例舉
| pKa | 名稱 | 化學式/結構式 |
| - 31.30 | 氟銻酸 | H[SbF] |
| - 19.20 | 氟銻磺酸(魔酸) | HSOF·SbF |
| - 18.00 | 碳硼烷酸 | |
| - 15.10 | 氟磺酸 | HSOF |
| - 10.00 | 高氯酸 | HClO |
| - 10.00 | 氫碘酸 | HI |
| - 9.00 | 氫溴酸 | HBr |
| - 8.00 | 鹽酸 | HCl |
| - 3.00 | 硫酸 | HSO |
| - 2.00 | 硝酸 | HNO |
| - 1.76 | 水合氫離子 | HO+ |
| 0.27 | 肼* | HN-NH |
| 0.804 | 碘酸 | HIO |
| 0.91 | 焦磷酸 | HPO |
| 1.271 | 乙二酸 | HOOCCOOH |
| 1.64 | 高碘酸 | HIO |
| 1.89 | 亞硫酸 | HSO |
| 1.99 | 硫酸氫根 | HSO |
| 1.99 | 乙二胺四乙酸(EDTA) | |
| 2.148 | 磷酸 | HPO |
| 2.26 | 砷酸 | HAsO |
| 3.128 | 檸檬酸 | |
| 3.14 | 亞硝酸 | HNO |
| 3.20 | 氫氟酸 | HF |
| 3.46 | 氰酸 | HCNO |
| 3.751 | 甲酸 | HCOOH |
| 3.858 | 乳酸 | |
| 4.04 | 抗壞血酸(維生素C) | |
| 4.19 | 丁二酸 | HOOCCHCHCOOH |
| 4.20 | 苯甲酸 | PhCOOH |
| 4.62 | 疊氮酸 | HN |
| 4.60 | 苯胺* | PhNH |
| 4.756 | 乙酸 | CHCOOH |
| 4.761 | 檸檬酸二氫根離子 | |
| 5.17 | 吡啶* | PyH |
| 6.352 | 碳酸** | HCO |
| 6.40 | 檸檬酸一氫根離子 | |
| 6.97 | 硫化氫 | HS |
| 6.99 | 乙二胺* | HNCHCHNH |
| 7.00 | 咪唑*(作為酸) | |
| 7.198 | 磷酸二氫根 | HPO |
| 7.205 | 亞硫酸氫根 | HSO |
| 7.537 | 次氯酸 | HOCl |
| 8.55 | 次溴酸 | HOBr |
| 9.236 | 硼酸 | B(OH) |
| 9.246 | 銨 | NH |
| 9.21 | 氫氰酸 | HCN |
| 9.33 | 苯甲胺* | |
| 9.60 | 矽酸 | Si(OH) |
| 9.81 | 三甲胺* | MeNH |
| 9.99 | 酚 | ArOH |
| 10.08 | 乙二胺* | |
| 10.329 | 碳酸氫根 | HCO |
| 10.5 | 次碘酸 | HOI |
| 10.62 | 甲胺* | MeNH |
| 10.63 | 乙胺* | EtNH |
| 10.77 | 二甲胺* | MeNH |
| 10.80 | 二乙胺* | EtNH |
| 11.01 | 三乙胺* | EtNH |
| 11.64 | 過氧化氫 | HO |
| 12.32 | 磷酸一氫根離子 | HPO |
| 12.50 | 胍* | |
| 12.90 | 硫氫根 | HS |
| 14.58 | 咪唑(作為鹼) | |
| 33 | 氨 | NH |
| 26.00 | 六甲基二矽基胺基鉀(KHMDS) | |
| 37.00 | 四甲基哌啶鋰(LiTMP) | |
| 37.00 | 二異丙基胺基鋰(LDA) | |
| 45.00 | 丙烷 | CHCHCH |
| 50.00 | 乙烷 | CHCH |
*銨及胺類物質的數據是其接受質子後形成的銨鹽的p K;
**碳酸的p K在計算時按碳酸的實際濃度計算,若假定溶液中所有CO均轉化為碳酸,則其p K=3.75。