遷越超電勢
正文
電荷物質遷越金屬溶液相界面所需的超電勢(見極化和超電勢)。遷越步驟(或稱活化步驟、電荷傳遞步驟)是電極反應的基本步驟,電與化學反應的相互作用是通過它來實現的。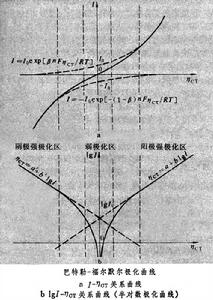 遷越超電勢
遷越超電勢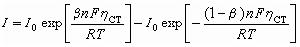 (1)
(1)
在強極化區(ηCT>100毫伏),對於陽極極化,式(1)可簡化為:

ηCT=a+blgI (2)
這就是塔費爾關係式,通過斜率b可求β,通過截距a可求I0。對陰極極化也同樣有塔費爾關係式。在弱極化區(ηCT≈0,即在平衡電勢附近),式(1)可簡化為:
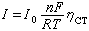 (3)
(3)
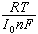 有電阻的量綱,稱遷越電阻RCT,表示遷越反應的阻力。RCT很小的電極可逆性好,不易極化,平衡電勢Ep很易維持,這種電極稱理想不極化電極。相反,RCT很大的電極可逆性不好,很易極化,稱理想可極化電極。
有電阻的量綱,稱遷越電阻RCT,表示遷越反應的阻力。RCT很小的電極可逆性好,不易極化,平衡電勢Ep很易維持,這種電極稱理想不極化電極。相反,RCT很大的電極可逆性不好,很易極化,稱理想可極化電極。