定律定義
升高溫度可使大多數反應的速率加快,通常認為溫度對濃度的影響可以忽略,原因來自於速率常數的k值增快,速率常數k值增大。范特霍夫根據大量實驗事實,提出一個經驗規則:溫度每上升10°C,反應速率提高2~4倍。
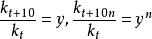 范特霍夫規則
范特霍夫規則該式稱為范特霍夫規則。式中,k、k和k為溫度t°C、(t+10)°C和(t+10n)°C時的反應速率常數,此比值也稱為反應速率的溫度係數γ。
實驗驗證
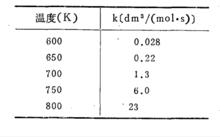 范特霍夫規則
范特霍夫規則現以CO與NO2的反應為例,討論溫度與速度的關係。反應速度常數k,不隨濃度改變而改變,即與濃度無關,而與溫度有關。假設濃度為1,則以化學反應速率作為化學反應常數,v=k。現將CO與NO2反應在600K至800K之間的常數列入下表。
從表中可以看出,600K至650K,化學反應速率增加近10倍;650K 至 700K 約6倍;而750K至800K 則不足4倍。溫度增加反應速度增加的倍數顯著減少,γ值隨之改變。
適用範圍
事實上范特霍夫規則只是在反應溫度不是太高,溫度變化幅度不太大,反應活化能比較低(50一240KJ·mol ) 的基元反應,這一範圍內有規律可循。然而實驗證明:真正的基元反應是很少的,化學反應速度與溫度的關係是複雜的。有些化學反應低於某一溫度幾乎觀察不到其作用,當溫度達到一定值後反應瞬間近乎完全,如爆炸。中和反應在常溫下便瞬間完成,更是觀察不到與溫度的變化關係;有的化學反應隨溫度的增加,其反應速度反而下 降,如NO與O生成NO;有些反應溫度升到一定值後出現分解、氣化或產生其他副反應,如有機物之間的 一些反應。尤其是現代工業與科學技術的發展,許多反應往往在催化劑的催化下或在較高的溫度下進行,反應速度與溫度的變化關係往往也不是什麼比例關係。
套用領域
范特霍夫規則雖然不準確,但當缺少數據時,用來粗略計算反應速率隨溫度的變化仍然是有用的。
定律影響
儘管此規則對引出活化能、活化分子概念起了較大作用,但在假定上不可忽視地存在錯誤。濃度、分壓可以 人為地加以控制,可以不隨溫度改變,而反應速率的溫度係數γ不可能不隨溫度改 變。因為溫度對化學反應速度的影響,分子碰撞頻率隨溫度增加是次要的,有限的。根據計算每增加10K約增加2%左右,而且不是所有碰撞都是有效的。主要的原因是溫度升高使反應的部分非活化分子獲得能量轉化成活化分子,體系的活化分子數目增加 的結果。常溫下,一般化學反應活化分子數是較少的,因此在溫度較低時每增加10K又非活化分子稍有轉化,活化分矛數就成倍增長,化學反應速度也因之成倍增 加。當溫度升到一定值後,體系的非活化分子已較多 ( 或大 部 ) 轉化成活化分子,活化分子百分率很高,基數巳很大。在此基 礎上再增加10K即 使仍有 非 活化分 子轉 化成 活化分子,由於基數大,活化分子數決不能再成倍增加,反應速度也就不能 一直保持每增加10K 增加2一4倍的正比關係,溫度係數值將隨溫度的不斷升高而變小。

