概述
胰島素受體(insulin receptor)
結構組成:胰島素受體是一個四聚體(單體結構右圖所示),由兩個α亞基和兩個β亞基通過二硫鍵連線。兩個α亞基位於細胞質膜的外側,其上有胰島素的結合位點;兩個β亞基是跨膜蛋白,起信號轉導作用。無胰島素結合時,受體的酪氨酸蛋白激酶沒有活性。當胰島素與受體的α亞基結合併改變了β亞基的構型後,酪氨酸蛋白激酶才被激活,激活後可催化兩個反應∶①使四聚體複合物中β亞基特異位點的酪氨酸殘基磷酸化,這種過程稱為自我磷酸化(autophosphorylation);②將胰島素受體底物(insulinreceptor substrate,IRSs)上具有重要作用的十幾個酪氨酸殘基磷酸化,磷酸化的IRSs能夠結合併激活下游效應物。胰島素受體家族均由多個模組化的結構域(modular domains)組成[21, 25],以β亞基跨膜區為界,IR的胞外結構域包括:富含亮氨酸的L1和L2(leucine-rich repeat)結構域,富含半胱氨酸的CR (cysteine-rich) 結構域,以及三個類纖連蛋白Fn III -1、Fn III -2和Fn III -3 結構域(fibronectin type III domain). Fn III -2結構域中還包括由120個胺基酸組成的插入域(insert domain,ID),其中含有多個連線αβ亞基和αα亞基的二硫鍵。研究表明,L1結構域和ID結構域是與配體結合的兩個重要結構域
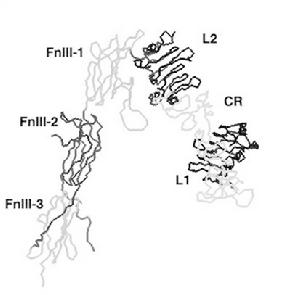 胰島素受體胞外單體結構
胰島素受體胞外單體結構