基本信息
中文名:甲矽烷
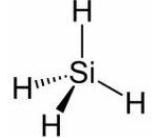 四氫化矽分子結構圖www.fjfoxiang.com
四氫化矽分子結構圖www.fjfoxiang.com外文名:silicontetrahydride
別名:四氫化矽
分子式:SiH4
相對分子質量:32.12
化學品類別:無機物--氣態氫化物
管制類型:不管制
儲存:陰涼、乾燥、通風保存
理化性質
物理性質
閃點:<-50℃
熔點:-185℃
沸點:-112℃
密度相對密度(水=1)0.68(-182℃)
液體密度(-185℃):711kg/m3
氣體密度(0℃,100kPa):1.42kg/m3
比容(21.1℃,101.325kPa):0.7518m/kg
氣液容積比(15℃,100kPa):412L/L
臨界溫度:-3.4℃
臨界壓力:4843kPa
臨界密度:242kg/m3
熔化熱(-186.40℃,<0.1kPa):24.62kJ/kg
氣化熱(-111.40℃,101.325kPa):342.89kJ/kg
比熱容(氣體,25℃,101.325kPa):Cp=1333.96J/(kg·K)
蒸氣壓:
(-168℃):1.33kPa
(-60℃):1040kPa
(-10℃):4150kPa
粘度(101.325kPa,0℃):0.0108mPa·S
表面張力(-111.4℃,101325kPa):15.11mN/m
導熱係數(101.325kPa,0℃):0.01918w/(m·K)
爆炸界限:0.8%~98%
溶解性:溶於苯、四氯化碳。引
化學性質
穩定,不被濃硫酸或強鹼分解。在紫外線照射下,可氯化成氯甲基三甲基矽烷。具有很高的熱穩定性,660~720℃下才開始分解。
在室溫下,矽烷是一種易燃的氣體,在空氣中,無需外加火源,矽烷就可以自燃。但是有學者認為,矽烷本身是很穩定的,在自然狀態下,是以聚合物的狀態存在的。在超過420攝氏度的環境下,矽烷會分解成矽和氫。因此矽烷可以被用來提純矽。
矽烷在常溫常壓下為具有惡臭的無色氣體。在室溫下著火,在空氣或鹵素氣體中發生爆炸性燃燒。即使用其它氣體稀釋,如果濃度不夠低.仍能自燃。矽烷在氬氣中含2%、氮氣中含2.5%、氫氣中含1%時,它仍能著火。矽烷濃度在小於1%時不燃,大於3%時自燃,1%~3%時可能燃燒。
SiH4+2O2—→SiO2+2H2O
燃燒產物為粉狀氧化矽和水,火焰溫度較低,在氬氣中含3%矽烷時為500~600℃。常溫下穩定,在300℃開始分解,600℃時分解加速,1000℃時完全分解成矽和氫。
SiH4—→Si+2H2↑
在中性或酸性水中比較穩定,但是在鹼性水溶液中容易分解。
SiH4+2H2O—→SiO2+4H2↑
SiH4+2KOH+H2O—→K2SiO3+4H2↑
矽烷是強還原劑,與重金屬鹵化物激烈反應,與氯、溴發生爆炸性反應,與四氯化碳激烈反應。因此對矽烷不能使用氟里昂滅火劑。矽烷不溶於乙醇、乙醚、苯、氯仿和四氯化矽。不與潤滑油、脂肪反應。對幾乎所有的金屬無腐蝕性。有時,玻璃中的鹼成分也能分解矽烷。溶解在二硫化碳中的矽烷遇到空氣也可發生爆炸。引
作用與用途
主要用於制半導體材料高純度矽,以及矽氧烷等衍生物。
使用注意事項
健康危害
侵入途徑:吸入。
健康危害:吸入甲矽烷蒸氣後,引起頭痛、頭暈、發熱、噁心、多汗;嚴重者面色蒼白,脈搏微弱,陷入半昏迷狀態。
毒理學資料及環境行為
急性毒性:LC509600ppm,4小時(大鼠吸入)
危險特性:遇明火、高熱極易燃燒。暴露在空氣中能自燃。與氟、氯等能發生劇烈的化學反應。
燃燒(分解)產物:氧化矽、氫氣。
應急處理處置方法
一、泄漏應急處理
迅速撤離泄漏污染區人員至上風處,並隔離直至氣體散盡,切斷火源。建議應急處理人員戴自給式呼吸器,穿一般消防防護服。切斷氣源,噴灑霧狀水稀釋,抽排(室內)或強力通風(室外)。如有可能,將殘餘氣或漏出氣用排風機送至水洗塔或與塔相連的通風櫥內。漏氣容器不能再用,且要經過技術處理以清除可能剩下的氣體。
二、防護措施
呼吸系統防護:空氣中濃度超標時,應該佩帶防毒口罩。必要時佩帶自給式呼吸器。
眼睛防護:一般不需要特殊防護,高濃度接觸時可戴安全防護眼鏡。
身體防護:穿工作服。
手防護:一般不需要特殊防護。
其它:工作現場嚴禁吸菸。進入罐或其它高濃度區作業,須有人監護。
三、急救措施
吸入:脫離現場至空氣新鮮處。保持呼吸道通暢。必要時進行人工呼吸。就醫。
滅火方法:切斷氣源。若不能立即切斷氣源,則不允許熄滅正在燃燒的氣體。噴水冷卻容器,可能的話將容器從火場移至空曠處。
製備
可由四氯矽烷或正矽酸乙酯與甲基碘化鎂反應來製取。也可由氯甲烷和矽粉,在銅催化劑存在下反應而製取。在高溫下反應然後仔細分餾製得。
