簡介
生成焓(enthalpy of formation)是某溫度下,用處於標準狀態的各種元素的最穩定單質生成標準狀態下單位物質的量(1mol)某純物質的熱效應,也稱生成熱。
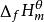 生成熱生成焓
生成熱生成焓在一定溫度和壓力下,由最穩定的單質生成1摩爾純物質的熱效應多稱生成焓,因為此生成反應的熱效應等於該過程體系焓的增量。標準狀態下(各單質與生成的純物質皆處於標準狀態)的生成焓稱為標準生成熱(standard heat of formation),現行手冊上稱為摩爾標準生成焓,簡稱標準生成焓,用符號 表示,單位是千焦/摩(KJ/mol)。
藉助物質的生成焓可直接求算在標準壓力下化學反應的衡壓反應熱。
相關概念介紹
焓
是工質在某一狀態下所具有的總能量,它是內能U和壓力勢能(流動能)PV之和,是一個複合狀態參數,其定義式為H=U+PV。焓用符號H表示,其單位為J或kJ。1千克工質的焓稱為比焓,用符號h表示,單位為J/kg或kJ/kg,則比焓為h=u+pv。因為焓是由狀態參數u、p、v組成的綜合量,對工質的某一確定狀態,u、p、v均有確定的數值,因而u+pv的數值也就完全確定。所以,焓是一個取決於工質狀態的狀態參數,它具有狀態參數的一切特徵。
標準生成焓
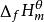 生成熱生成焓
生成熱生成焓由標準狀態(壓力為100kPa,溫度TK)下最穩定單質生成標準狀態下單位物質的量的化合物的熱效應或焓變(△H)稱為該化合物的標準生成熱(或焓),以符號△fH表示。最穩定的單質的標準生成熱規定為零。(摩爾的話那么就在規定生成的物質是1mol)在標準狀態下,由參考態單質生成1摩爾某物質的化學反應標準摩爾焓變稱該物質的標準生成焓,溫度常選取298.15K,用 (298.15K)表示。
標準燃燒焓
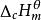 生成熱生成焓
生成熱生成焓可燃物質B在標準的壓力下,反應溫度T時,單位量的物質B與氧進行完全氧化為同溫下指定產物時的標準摩爾焓變。用 (298.15K)表示。
常見物質的標準摩爾生成焓
| 物質 | 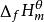 生成熱生成焓 生成熱生成焓 |
| Ag(s) | 0 |
| Br(g) | 111.884 |
| Br(l) | 0 |
| C(金剛石) | 1.896 |
| CO (g) | - 110.525 |
| CO(g) | -393.511 |
| CaO (s) | -635.6 |
| (s) | -986.5 |
| Ca(OH) (g) | -241.825 |
| H2O (l) | -285.838 |
| O(g) | 0 |
| N(g) | 0 |
| CH | -74.847 |
| CH(g) | 52.283 |
| CH (l) | 49.028 |
生成焓相關計算
標準摩爾生成焓計算標準摩爾反應焓
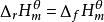 生成熱生成焓
生成熱生成焓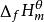 生成熱生成焓
生成熱生成焓(產物生成焓)-(反應物生成焓)
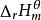 生成熱生成焓
生成熱生成焓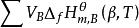 生成熱生成焓
生成熱生成焓(T)=
標準摩爾燃燒焓計算標準摩爾反應焓
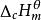 生成熱生成焓
生成熱生成焓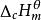 生成熱生成焓
生成熱生成焓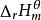 生成熱生成焓
生成熱生成焓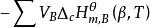 生成熱生成焓
生成熱生成焓(T)=(反應物燃燒焓)-(產物燃燒焓)=
標準摩爾生成焓與標準摩爾燃燒焓
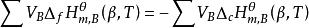 生成熱生成焓
生成熱生成焓生成焓計算中的優點
套用燃燒焓計算熱效應時,往往遇到由較大的數值差減以獲得較小的數值,這樣必然會引入較大的誤差,因此這種計算方法往往不如生成焓法準確。
