定義
溶媒是能溶解氣體、固體、液體而成為均勻混合物的一種液體。習慣上把氣體和固體叫溶質,液體叫溶劑。對於兩種液體所組成的溶液,通常把含量較多的組分叫溶劑,少者叫溶質。分為無機溶劑和有機溶劑兩大類。水是套用最廣泛的無機溶劑,酒精、汽油、氯仿及丙酮等是常用的有機溶劑。
複合溶媒是由兩種或兩種以上的溶媒按一定比例混合而成的溶媒,非極性分子和弱電解質在水中的溶解度往往很小,這些藥物可因加入與水能混溶的有機溶媒而使其溶解度增加。
溶媒萃取原理
萃取是一種初步分離純化技術。萃取法根據參與溶質分配的兩相不同而分為多種,如液固萃取、溶媒萃取、雙水相萃取、液膜萃取、反膠團萃取、超臨界萃取等方法,每種方法具有不同的特點而適用於不同產物的分離純化。
溶媒萃取法通常用於去除雜質及分離混合物。它的原理是:欲從溶液中萃取某一成分,利用該物質在兩種互不相溶的溶劑中溶解度的不同,使之從一種溶劑轉入另一種溶劑,從而使雜質得以去除。
萃取效率的高低是以分配定律為基礎的。在恆溫恆壓下,一種物質在兩種互不相溶的溶劑(A與B)中的分配濃度之比是一常數,此常數稱為分配係數K,可用下式表示:
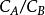 溶媒
溶媒上層溶劑(A)中溶質的濃度 /下層溶劑(B)中溶質的濃度==常數=K(分配係數)
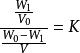 溶媒
溶媒即:
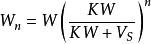 溶媒
溶媒同理可得:
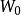 溶媒
溶媒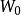 溶媒
溶媒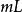 溶媒
溶媒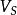 溶媒
溶媒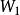 溶媒
溶媒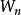 溶媒
溶媒式中,為被提取物的總質量,g;為原溶液的體積,;為每一次提取所用提取溶液的體積;為提取一次後,被提取物在原溶液中的剩餘量;為提取n次後,被提取物在原溶液中的剩餘量;n為提取次數;K為被提取物在原溶劑和提取溶劑中的分配係數。
若已知物質在兩溶媒內的分配係數,則可以此算出在一定條件下提取多少次最合適。
有機溶媒
如脂肪烴、芳香烴、醇、乙二醇及其衍生物、酮、酸、酯等,有機溶媒主要用於溶解油脂等有機活性成分,如一元醇(甲醇、乙醇、丁醇、辛醇、高碳支鏈醇等),常作為農藥、樹脂、脂肪等的溶劑、稀釋劑等;酯類溶媒(代表如乙酸乙酯、乙酸丁酯等),其中乙酸丁酯在硝基漆和聚氨酯漆中套用最為廣泛;酮類溶媒(丙酮、甲乙酮、環己酮、甲戊酮等)是一類性能優良的溶劑,由於溶解力強、選擇性高、低毒或無毒、性能穩定、腐蝕性小、作業性好、揮發性低、操作損失少、容易回收等特點而取得了快速的發展,廣泛用於化妝品、清洗劑、油墨、塗料、黏合劑、自有機合成、醫藥及農藥等行業中。
無機溶媒
如水、液氮、液態二氧化碳、濕酸、熔鹽等,其中水是最重要的無機溶媒。
天然水中含有泥砂、雜質及細菌等,為適應不同配方產品對對水質的水質要求,需要對水進行淨化處理與檢驗、根據處理方法不同。水可分為自來水(原水)、硬水與軟水、蒸餾水和去離子水(離子交換水)四種。
溶媒的套用
在實酸室內溶解的套用是多方面的。化學反應通常是在參與反應物混合均勻的條件下容易進行,也就是保持各反應物固有最大的接觸面時容易進行。如參與反應的物質互不相容,可根據情況適當的加入惰性溶媒使原料溶解但儘可能不溶解反應生成物。
應注意某些溶媒與溶質不起化學反應,但能生成不甚穩定的加成產物,這就對反應本身有影響,所以要很合適的選擇某一惰性溶媒,使反應收到最好的成果是很重要的。
變更溶媒的用量可以調節反應的速度,因為稀釋度的增加能減低單位時間單位體積內反應物分子相互作用的機會。在進行反應時,如遇到反應溫度超過了許可限度而有不良影響時,則可加入沸點與該反應溫度相當的適當溶媒,既可避免上述的困難。
在實驗室操作中溶媒的套用非常廣泛,如常套用在化合物的分離及用再結晶法精製反應產物等。因此關於溶媒的性質及在不同溫度時溶質在溶媒中的溶解度都是需要了解的。
在許多情況下,特別是在微量操作時採用溶液,能夠以容量法較之以重量法更簡便、更迅速的稱出所需量的物質。
相關名詞
溶液
溶液亦稱“溶體”。由兩種或兩種以上不同物質所組成的均勻物系,在這物系中的任何部分都具有相同的性質。液態溶液如食鹽水和糖水等;固態溶液如銅鎳合金等。一般的溶液系指水溶液。根據溶液中溶質含量的多少,分為濃溶液和稀溶液。又根據溶質在溶液中的含量等子或小於該溫度(和壓力)下的溶解度,可分為飽和溶液和不飽和溶液。溶液在工業、農業、科學研究及日常生活中起到重大的作用。
溶解度
在一定的溫度和壓力下,物質在一定量溶劑中溶解的最高置。一般以100克溶劑中能溶解物質的克數來表示。如在20℃時,100克水中可以溶解氯酸鉀7.3克,因此,氯酸鉀在該溫度的溶解度是7.3克/100克水。物質的溶解度隨溫度或壓力的改變而不同。
溶質在溶劑中的濃度達到其溶解度的溶液被稱為飽和溶液,不到溶解度的稱為不飽和溶液,超過溶解度時,稱為過飽和溶液。過飽和溶液通常將較高溫度時製備的飽和溶液,在不與純溶質接觸的條件下,緩慢地冷卻而得。這種溶液一般是不穩定的,如投入該溶質的晶粒,即會使過量的溶質析出而變成飽和溶液。

