基本信息
【通用名】注射用阿替普酶
【商品名】愛通立
【漢語拼音】Zhusheyong A'tipumei
【英文商品名稱】
Actilyse
[Recombinant Human Tissue Plasminogen Activator for Injection ( rt-PA)]
【主要成分】
活性成份:注射用阿替普酶。
輔料:精氨酸、磷酸、吐溫80及注射用水。
【性狀】白色至類白色凍乾粉末,無嗅
【規格】
20mg/支,20mg包裝盒內有一個含20mg活性成份(乾粉總重933mg)的小瓶及一個內裝20ml注射用水的注射用小瓶。
50mg/支,50mg包裝盒內有一個含50mg活性成份(乾粉總重2333mg)的小瓶及一個內裝50ml注射用水的注射用小瓶。
【劑型】注射劑(乾粉+注射用水)
【包裝】
無色玻璃瓶,1支/盒(含稀釋液)。
20毫克包裝盒內有一個含20毫克活性成份(乾粉總重933毫克)的小瓶,一個內裝20毫升注射用水的注射用小瓶及一個移液套管。
50毫克包裝盒內有一個含50毫克活性成份(乾粉總重2333毫克)的小瓶,一個內裝50毫升注射用水的注射用小瓶及一個移液套管。
【貯藏】
保存於原始包裝中。避光,低於25℃貯存。溶液配製後,推薦立即使用。已經證實配製好的溶液能夠在2~8℃保持穩定24小時,勿冷凍。請存放於兒童伸手不及處!
【有效期】36個月
【執行標準】
進口藥品註冊標準:JX19990020
【批准文號】
進口藥品註冊證號:S20110051、S20110052
【生產企業】
企業名稱:Boehringer Ingelheim Pharma GmbH&Co, KG
藥品包裝外觀圖
 藥品包裝外觀圖
藥品包裝外觀圖適應症
1. 急性心肌梗死
對於症狀發生6小時以內的患者,採取90分鐘加速給藥法(參見【用法用量】)。
對於症狀發生6-12小時以內的診斷明確的患者,採取3小時給藥法(見【用法用量】)。
本品已被證實可降低急性心肌梗死患者30天死亡率。
2. 血流不穩定的急性大面積肺栓塞
可能的情況下應藉助客觀手段明確診斷,如肺血管造影或非侵入性手段如肺掃描等。尚無證據顯示對與肺栓塞相關的死亡率和晚期發病率有積極作用。
3. 急性缺血性腦卒中
必須預先經過恰當的影像學檢查排除顱內出血之後,在急性缺血性腦卒中症狀發生後的3小時內進行治療。
用法用量
應在症狀發生後儘快給藥。按以下指導劑量給藥。
無菌條件下將一小瓶愛通立乾粉(10、20或50毫克)按照下列表格所示用注射用水溶解為1毫克/毫升或2毫克/毫升的濃度。
使用愛通立20毫克或50毫克包裝中的移液套管完成上述溶解操作。如果是愛通立10毫克,則使用注射器。
| 愛通立規格 | 10毫克 | 20毫克 | 50毫克 |
| 終濃度為 | 加入乾粉中的注射用水體積(毫升) | ||
| a)1mg/ml | 10 | 20 | 50 |
| b)2mg/ml | 5 | 10 | 25 |
配製好的溶液應通過靜脈給藥。配製的溶液可用滅菌生理鹽水(0.9%)進一步稀釋至0.2毫克/毫升的最小濃度。但是不能繼續使用滅菌注射用水或用碳水化合物注射液如葡萄糖對配製的溶液作進一步稀釋。本品不能與其它藥物混合,既不能用於同一輸液瓶也不能套用同一輸液管道(肝素亦不可以)。有關製備和處置的更多實踐指導見【貯藏】和【配伍禁忌】。
在兒童和青少年中使用愛通立的經驗還很有限。本品禁忌用於治療兒童和青少年中的急性缺血性腦卒中患者(見【禁忌】)。
1. 心肌梗死
 心肌梗死a1
心肌梗死a1a) 對於在症狀發生6小時以內的患者,採取90分鐘加速給藥法:
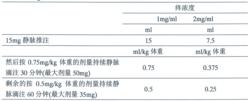 心肌梗死a2
心肌梗死a2體重在65公斤以下的患者,給藥總劑量應按體重調整,見下表。
 心肌梗死b
心肌梗死bb) 對於症狀發生6-12小時以內的患者,採取3小時給藥法。
體重在65公斤以下的患者,給藥總劑量不應超過1.5毫克公斤體重。
本品最大劑量為100毫克。
輔助治療:
抗血栓形成藥物的輔助治療需依據目前治療ST段抬高的急性心肌梗死的國際指南上的推薦;除非有禁忌,症狀發生後應儘快給予阿司匹林並維持終生使用。
2. 肺栓塞
 肺栓塞
肺栓塞本品100毫克應持續2小時靜脈滴注。最常用的給藥方法為:
體重不足65公斤的患者,給藥總劑量不應超過1.5毫克/公斤體重。
輔助治療:
靜滴本品後,當aPPT值低於正常上限兩倍時,應給予(或再次給予)肝素。肝素劑量應根據aPTT值調整,需維持aPTT值在50-70秒(參考值的1.5-2.5倍)。
3. 急性缺血性腦卒中
治療必須由神經科醫師進行(參見【禁忌】和【注意事項】)。
推薦劑量為0.9毫克/公斤體重(最大劑量為90毫克),總劑量的10%先從靜脈推入,剩餘劑量在隨後60分鐘持續靜脈滴注。
治療應在症狀發作後的3小時內開始。
輔助治療:
在症狀發生的最初24小時內,此治療方案與肝素和阿司匹林合用的安全性和有效性尚未進行系統研究。在本品治療後的24小時以內應避免使用阿司匹林或靜脈給予肝素。若給予肝素以防治其它症狀(如防止深靜脈栓塞發生),則劑量不得超過10,000國際單位,並由皮下注射給藥。
不良反應
概述
本品不良反應的發生頻率分類依照MedDRA中的定義*。
*MedDRA頻率分類:
很常見 >1/10
常見 >1/100和≤1/10
不常見 >1/1,000和≤1/100
罕見 >1/10,000和≤1/1,000
非常罕見 ≤1/10,000
頻率未知(不能從現有數據估計)
除了治療腦卒中時發生的顱內出血和治療心肌梗死時發生的再灌注後心律失常,沒有醫學依據能夠假設愛通立在治療肺栓塞和急性缺血性腦卒中時的副作用與其治療心肌梗死時所發生的副作用在數量和程度上有所不同。
出血
與本品相關的最常見的不良反應就是出血,可導致紅細胞比積和/或血紅蛋白下降:
| 很常見 : | 治療急性缺血性腦梗死患者時顱內出血是主要的不良反應(如腦出血,腦血腫,出血性腦卒中,腦卒中的出血性轉變,顱內血腫,蛛網膜下腔出血可達15%,但不會引起整體死亡率和致殘率的增加) 血管損傷處出血(如血腫) |
| 常見 : | 治療急性缺血性腦梗死患者時發生的顱內出血(如腦出血,腦血腫,出血性卒中,卒中的出血性轉變,顱內血腫,蛛網膜下腔出血) 咽部出血 胃腸道出血(如胃出血,胃潰瘍出血,直腸出血,嘔血,黑便,口部出血,牙齦出血) 瘀斑 泌尿生殖器出血(如血尿,泌尿道的出血) 注射部位處出血(穿刺部位處出血,導管放置部位處血腫,導管放置部位處出血) |
| 不常見 : | 肺出血(如咯血,胸腔積血,呼吸道出血) 鼻出血 耳出血 |
| 罕見 : | 眼出血 心包積血 腹膜後出血(如腹膜後血腫) |
| 頻率未知 * | 實質臟器的出血(如肝臟出血) |
死亡和永久殘疾的報告見於發生卒中(包括顱內出血)和其他嚴重出血事件的患者。
如果有潛在的出血危險尤其是腦出血,則應停止溶栓治療。因本品的半衰期短,對凝血系統影響輕微,所以一般不必給予凝血因子。大多數出血患者,可經中斷溶栓和抗凝治療,擴容及人工壓迫損傷血管來控制出血。如在出血發生的4小時內已使用肝素,則應考慮使用魚精蛋白。對於少數使用保守治療無效的患者,可輸注血製品,包括冷沉澱物,新鮮冰凍血漿和血小板,每次使用後應做臨床及實驗室的再次評估。通過輸注冷沉澱物達到纖維蛋白原的目標值1克/升。抗纖維蛋白溶解劑可作為最後一種治療選擇。
免疫系統異常
| 罕見: | 過敏反應/過敏樣反應(如:過敏反應包括皮疹,蕁麻疹,支氣管痙攣,血管源性水腫,低血壓,休克,或其他與過敏反應有關的症狀。) |
| 非常罕見: | 嚴重的過敏反應 |
| 如果發生了過敏反應,就應採用常規的抗過敏治療。在這種情況下,會同時給大部分患者給予血管緊張素轉換酶抑制劑。尚不清楚本品可致的明確過敏反應(IgE介導型)。在極少的例子中可以觀察到短暫生成阿替普酶的抗體並且滴度低,但是這並不能形成一個臨床相關的結論。 | |
神經系統異常
| 非常罕見: | 與神經系統相關的事件(如癲癇發作,驚厥,失語,言語異常,譫妄,急性腦綜合症,激越,意識模糊,抑鬱,精神病),通常與同時發生的缺血性或出血性腦血管疾病相關 |
心臟系統異常
和其他的溶栓藥物一樣,下列不良事件可由心肌梗死和/或溶栓治療引起
| 很常見: | 再缺血/心絞痛,低血壓和心力衰竭/肺水腫 |
| 常見: | 心臟停搏,心源性休克和再梗塞 |
| 不常見: | 再灌注後心律失常(如心律不齊,期外收縮,I°至完全的房室傳導阻滯,房顫/房撲,心動過緩,心動過速,室性心律不齊,室性心動過速/室顫,電機械分離[EMD]) 二尖瓣反流,肺栓塞,其他系統組織的栓塞/腦栓塞,室間隔缺損 |
這些事件可能有生命危險甚至導致死亡。
血管異常
| 罕見: | 血栓栓塞,可導致相關臟器發生相應後果 |
胃腸道異常
| 罕見: | 噁心(也發生於心肌梗死症狀) |
| 頻率未知 * : | 嘔吐(也發生於心肌梗死症狀) |
未分類的
| 常見: | 血壓下降 |
| 頻率未知 * : | 體溫升高 |
不
損傷,中毒和操作併發症
| 頻率未知 * : | 膽固醇結晶栓塞,可導致相關器官發生相應後果 |
外科和醫學程式
| 頻率未知 * : | 輸血(必要時) |
*不良反應頻率來源於上市後的數據。該頻率有95%的可能性不大於“罕見”,也有可能會更低。
由於這些不良反應不是來源於同一個臨床試驗資料庫(8299例),因此不能估訓頻率的精確數值。
禁忌
對本品的活性成份和任何其他組成成份過敏者。
本品不可用於有高危出血傾向者,如:
l 目前或過去6個月中有顯著的出血疾病
l 已知出血體質
l 口服抗凝血藥,如華法令
l 顯著的或是近期有嚴重的或危險的出血
l 已知有顱內出血史或疑有顱內出血
l 疑有蛛網膜下腔出血或處於因動脈瘤而導致蛛網膜下腔出血狀態
l 有中樞神經系統病變史或創傷史(如腫瘤、動脈瘤以及顱內或椎管內手術)
l 最近(10天內)曾進行有創的心外按壓、分娩或非壓力性血管穿刺(如鎖骨下或頸靜脈穿刺)
l 嚴重的未得到控制的動脈高血壓
l 細菌性心內膜炎或心包炎
l 急性胰腺炎
l 最近3個月有胃腸潰瘍史、食管靜脈曲張、動脈瘤或動脈/靜脈畸形史
l 出血傾向的腫瘤
l 嚴重的肝病,包括肝功能衰竭、肝硬變、門靜脈高壓(食管靜脈曲張)及活動性肝炎
l 最近3個月內有嚴重的創傷或大手術
治療急性心肌梗死時的補充禁忌:
出血性卒中病史或不明起因的卒中病史
l 過去6個月中有缺血性腦卒中或短暫性腦缺血發作(TIA)的病史,3小時內發生的缺血性腦卒中除外
治療急性肺栓塞時的補充禁忌:
l 出血性卒中病史或不明起因的卒中病史
l 過去6個月中有缺血性腦卒中或短暫性腦缺血發作(TIA)的病史,3小時內發生的缺血性腦卒中除外
治療急性缺血性腦卒中時的補充禁忌:
l 缺血性腦卒中症狀發作已超過3小時尚未開始靜脈滴注治療或無法確知症狀發作時間
l 開始治療前神經功能缺陷輕微或症狀迅速改善
l 經臨床(NIHSS> 25)和/或影像學檢查評定為嚴重腦卒中
l 腦卒中發作時伴隨癲癇發作
l CT掃描顯示有顱內出血跡象
l 儘管CT掃描未顯示異常,仍懷疑蛛網膜下腔出血
l 48小時內曾使用肝素且凝血活酶時間高於實驗室正常值上限
l 有腦卒中史並伴有糖尿病
l 近3個月內有腦卒中病史
l 血小板計數低於100×10/L
l 收縮壓高於185毫米汞柱或舒張壓高於110毫米汞柱,或需要強力(靜脈內用藥)治療手段以控制血壓在限制範圍內
l 血糖低於50mg/dl或高於400mg/dl
兒童及老年患者用藥:
本品不能用於18歲以下及80歲以上的急性腦卒中患者治療。
注意事項
必須有足夠的監測手段才能進行溶栓/纖維蛋白溶解治療。只有經過適當培訓且有溶栓治療經驗的醫生才能使用本品,並且需有適當的設備來監測使用情況。建議在備有標準復甦裝置和藥物的地點使用愛通立進行治療。
過敏
治療之後沒有觀察到與重組人類組織型纖溶酶原激活物分子結合的持續性抗體的形成。本品沒有重複用藥的系統經驗。與本品給藥有關的過敏反應是罕見的,過敏反應是由於對阿替普酶活性物質過敏、慶大黴素(生產過程中的痕量殘留)或其他輔料引起的。裝有阿替普酶藥粉的瓶塞中含有天然橡膠(乳膠的衍生物),這種橡膠可以引起過敏反應。一旦發生了過敏反皮,應停止給藥,並且採取適當的治療。
老年患者顱內出血的危險增加,因此,對老年患者應仔細權衡使用本品的風險及收益。
到目前為此,本品用於兒童和青少年的經驗還很有限。
如同其他所有溶栓劑,應該慎重權衡預期治療收益和可能出現的危險,特別是對於以下患者:
l 較小的近期損傷,如活組織檢查、主要血管的穿刺、肌肉注射及復甦時採用的心臟按壓;
l 在【禁忌】中未曾提及的出血傾向;
避免使用硬質導管。
接受口服抗凝劑治療的患者:
當在對產品進行適當的抗凝血活性檢測中發現沒有臨床相關活性時,可以考慮套用本品,如維生素K拮抗劑INR≤l.3,或其他相關的測試顯示結果在正常上限內。
治療急性心肌梗死時的補充注意事項:
本品的用量不應超過100毫克,否則顱內出血的發生率可能增高。
應確保本品的劑量遵從【用法用量】中的規定。
本品重複用藥的經驗有限,使用本品一般不引起過敏反應。如發生過敏樣反應,應停止滴注本品並給予相應的治療。
應該慎重權衡預期治療收益和可能出現的危險,特別是對於收縮壓高於160毫米汞柱的患者。
GPIIb/IIIa 拮抗劑:
合併GPIIb/IIIa拮抗劑的治療可增加出血的危險。
治療缺血性腦卒中時的補充注意事項:
特別注意
只有神經專科已經過培訓的且有經驗的醫師才能進行相應治療。通過遠程診斷方法證實的適應症或許也可被認為是合適的。
特殊注意事項,收益 / 風險比可能下降:
與治療其他適應症相比,本品用於急性缺血性腦卒中治療時顱內出血的風險明顯增加,因為出血主要發生在梗塞部位。需特別注意以下情況:
l 所有【禁忌】中包括的事項以及所有可能增加出血風險的情況
l 微小的尚無症狀的腦動脈瘤
l 預先經阿司匹林治療的患者可能有更大的腦出血的風險,尤其是在症狀發生後沒有及時給予本品治療的。在這種情況下,本品的用量不得超過0.9毫克/公斤體重(最大劑量90毫克)。
如果症狀發生已超過3小時,則患者不得再用本品治療(見【禁忌】),因為會有不良的收益/風險比值,主要基於以下情況:
l 隨著時間推移,預期的陽性治療效果會下降
l 患者死亡率增加,尤其是預先經阿司匹林治療的
l 症狀性出血的風險增加
臨床經驗證明應當在治療過程中進行血壓監測且需延長至24小時。如果收縮壓超過180毫米汞柱或舒張壓高於105毫米汞柱,建議進行靜脈內抗高血壓治療。
在有卒中史或其糖尿病未得到控制的患者,本品治療的獲益降低,但是這些患者仍然可以從治療中受益。
對於非常輕度的腦卒中患者,治療風險超過收益(見【禁忌】)。
對於非常嚴重的腦卒中患者,其腦出血風險和死亡率均增高(見【禁忌】),不得使用本品治療。
廣泛性梗塞的患者其預後不良的風險很高,包括可能出現嚴重出血和死亡。對這些患者,應仔細權衡收益/風險比。
隨著患者年齡、腦卒中嚴重性和血糖水平的增高,其預後良好的可能性下降而發生嚴重功能缺陷、死亡或腦出血的可能性增加,與治療本身無關。年齡80歲以上,嚴重腦卒中(經臨床診斷或影像學診斷)及血糖基礎值小於50mg/dl或大於400mg/dl的患者不得使用本品治療(見【禁忌】)。
其它特殊注意事項:
缺血部位的再灌注可誘發梗塞區域的腦水腫。
由於可能導致出血風險增加,在本品溶栓後的24小時內不得使用血小板聚集抑制劑治療
孕婦及哺乳期婦女用藥
妊娠和哺乳婦女使用本品的經驗非常有限。
已進行的高於人類使用劑量的阿替普酶的非臨床研究顯示出胎兒不成熟性和/或胚胎毒性,這是繼發於藥物已知的藥理活性。阿替普酶不被認為有致畸作用(參見【藥理毒理】)。
對於急性的危及生命的疾病,應權衡收益與潛在危險。
目前尚不知曉愛通立是否能夠泌入乳汁。
沒有本品關於生育力的臨床數據。已進行的非臨床研究顯示阿替普酶在生育力上沒有副作用(參見【藥理毒理】)。
兒童用藥
本品不能用於18歲以下的急性腦卒中患者治療。
老年用藥
本品不能用於80歲以上的急性腦卒中患者治療。
藥物相互作用
在急性心肌梗死的患者中,本品與常用藥物的相互作用的正規研究尚未開展。
在套用本品治療前、治療同時或治療後24小時內使用香豆素類衍生物、口服抗凝劑、血小板聚集抑制劑、普通肝素、低分子肝素和其它抑制凝血的藥物可增加出血危險(參見【禁忌】)。
同時使用血管緊張素轉換酶抑制劑可能增加過敏樣反應的危險。在出現如此反應的患者中,有大部分患者正在同時使用血管緊張素轉換酶抑制劑的治療。
合併GPIIb/llla拮抗劑的治療可增加出血的危險。
藥物過量
儘管本品具有相對纖維蛋白特異性,但過量後仍會出現顯著的纖維蛋白原及其它凝血因子的減少。大多數情況下,停用本品治療後,生理性再生足以補充這些因子。然而,如發生嚴重的出血,建議輸入新鮮冰凍血漿或新鮮全血,如有必要可使用合成的抗纖維蛋白溶解劑。
配伍禁忌
配製的溶液可用滅菌的注射用生理鹽水(0.9%)稀釋至0.2毫克/毫升的最小濃度。
但是不能繼續使用注射用水或用碳水化合物注射液如葡萄糖對配製的溶液作進一步稀釋,因為可導致溶液混濁。
本品不能與其它藥物混合,既不能用於同一輸液瓶也不能套用同一輸液管道(肝素亦不可以)。
若配製最終濃度為1毫克/毫升的溶液,全部溶劑需被轉入含乾粉的小瓶中。本品20毫克和50毫克兩種規格中配以移液管以完成上述操作。若是10毫克的規格,應使用注射器。
若配製最終濃度為2毫克/毫升的溶液,僅需使用半量的溶劑。在這種情況下通常需要使用注射器將所需的溶劑量移入含愛通立乾粉的小瓶。
用法用量部分中的表格顯示使用不同規格的愛通立配製兩種不同的最終濃度溶液時所需的溶劑體積。
配製的溶液呈清澈無色至淡黃色。在使用之前請再觀察其色狀。
配製好的溶液僅可單次使用。任何未使用的溶液均應廢棄。
藥理毒理
在大鼠和絨猴的亞急性毒理研究中,未發現其它預期之外的不良事件。
致突變試驗中未發現有致突變傾向。
藥理學特性
藥物治療類別:抗血栓藥物,ATC code:B 01 A D 02
愛通立的活性成份是阿替普酶(重組人組織型纖維蛋白溶酶原激活劑),一種糖蛋白,可直接激活纖溶酶原轉化為纖溶酶。當靜脈給予時,本品在循環系統中表現出相對非活性狀態。一旦與纖維蛋白結合後,本品被激活,誘導纖溶酶原轉化為纖溶酶,導致纖維蛋白降解,血塊溶解。
在一項入選了40,000多例急性心肌梗死患者的研究(GUSTO)中,治療組給予100毫克本品90分鐘滴注,靜脈滴注肝素輔助治療,30天死亡率為6.3%;對照組予以150萬單位鏈激酶60分鐘滴注,輔以皮下或靜滴肝素對比,其30天死亡率為7.3%。同時本品治療的患者溶栓後60分鐘和90分鐘的血管再通率高於鏈激酶治療的患者,在180分鐘及以後時間的血管再通率兩組沒有差異。
本品治療的患者比未經溶栓治療的患者30天死亡率低。
α-羥基丁酸脫氫酶(HBDH)的釋放減少。與未經溶栓療法的患者相比,本品治療的患者總體心室功能及局部心肌壁運動功能受損較輕。
心肌梗死
一項安慰劑對照試驗(LATE)表明,發病後6-12小時內給予治療,經本品100毫克3小時治療的患者30天死亡率比對照組低。對於某些出現明顯心肌梗死症狀的病例,發病後24小時內的溶栓治療也有益處。
肺栓塞的研究
急性大面積肺栓塞伴血流動力學不穩定的患者使用本品溶栓,可迅速縮小血栓,並降低肺動脈壓。無死亡率的資料。
急性缺血性腦卒中的研究
在兩項美國試驗(NINDS A/B)中,與安慰劑相比,使用本品預後良好(無功能缺陷或輕微功能缺陷)的患者比例明顯增高。在兩個歐洲試驗和另外一個美國試驗中未能證實上述發現,然而在這後三個試驗中,大部分患者未能在腦卒中發生的3小時內接受治療。隨後的分析表明在腦卒中發生3小時內接受本品治療的療效是肯定的。儘管嚴重的和致命性的顱內出血的風險增高,但與安慰劑相比,預後良好的差值為14.9%(95%可信區間為8.1%至21.7%)。此數據無法給出關於治療對死亡率影響的確切結論。然而總體來說,如果在卒中症狀發生的3小時內給予本品且遵循本說明書描述的各注意事項,套用本品的收益還是大於可能的風險的。
隨後進行的對所有臨床數據的分析顯示,與症狀發生3小時內就給予本品治療的患者相比,在症狀發生3小時後(3至6小時)才接受本品治療的患者療效相對差,而且風險增高,這導致其收益/風險比值落在原來0-3小時內可接受的值以外。
由於本品具有纖維蛋白相對特異性,100毫克的本品可能導致循環中纖維蛋白原在4小時內減少至60%左右,但一般24小時後可恢復到80%以上。4小時後纖溶酶原和α-2-抗纖溶酶分別減少至20%和35%左右,24小時後可恢復到80%以上。只有少數患者出現明顯的較長時間的循環纖維蛋白原水平下降。
ECASS III試驗是在3—4.5小時的時間窗內在急性腦卒中患者中進行的一項安慰劑對照、雙盲試驗。主要終點是90天的殘疾情況,將結果二分化為有利結果(改良的Rankin量表[mRS]0至1)或不利結果(mRS 2至6)。共821例患者隨機分組(阿替普酶組418人,安慰劑組403人)。阿替普酶組(52.4%)與安慰劑組相比(45.2%,比值比[OR],1.34; 95% CI 1.02-1.76;p= 0.038)有更多的患者獲得良好結果。阿替普酶組的ICH/SICH的發病率高於安慰劑組中(所有ICH 27.0% versus 17.6%,p=0.0012;按NINDS定義的SICH 7.9% vs. 3.5%,p=0.006;按ECASS III定義的SICH 2.4% vs.0.2%,p=0.008)。與安慰劑組(8.4%; p=0.681)相比,阿替普酶組(7.7%)的死亡率較低但沒有顯著差異。ECASS III結果表明在症狀發作後3-4.5小時內急性缺血性腦卒中患者中使用阿替普酶在臨床結果上有顯著改善。
阿替普酶治療急性缺血性腦卒中發作到治療(OTT) 4.5小時內使用的安全性和有效性的試驗在一個正在進行的AIS註冊登記中已評估(SITS-ISTR,腦卒中註冊登記中溶栓的安全實施)。3個月時3-4.5小時時間窗內的症狀性顱內出血的發生率(根據NINDS定義)(2.20%)比在3小時時間窗內的發生率( 1.70%)稍高。3到4.5小時時間窗內的死亡率(12.4%)與在0到3小時時間窗內的死亡率(12.3%)相似
藥代動力學
本品可從血循環中迅速清除,主要經肝臟代謝(血漿清除率550~680毫升/分鐘)。相對血漿α半衰期(T)是4~5分鐘。這意味著20分鐘後,血漿中本品的含量不到最初值的10%。深室殘留量的β半衰期約為40分鐘。
指南推薦
1. 重組組織型纖溶酶原激活劑靜脈溶栓治療缺血性卒中中國專家共識 (2012 版 ) 推薦患者靜脈 rt-PA 溶栓治療
疑似急性缺血性卒中患者發病4.5h內,對適應症患者推薦基於臨床和平掃CT選擇患者的靜脈rt-PA溶栓治療,越早溶栓,獲益越大、風險越小 (I級推薦,A級證據)
2. 中國急性缺血性腦卒中診治指南 2010 推薦相關患者儘快靜脈給予 rtPA 溶栓治療
對缺血性腦卒中發病3h內(I級推薦,A級證據)和3-4.5h(I級推薦,B級證據)的患者,應根據適應證嚴格篩選患者,儘快靜脈給予rtPA溶栓治療。
3. 美國心臟協會和美國卒中協會( AHA/ASA )《急性缺血性腦卒中患者的早期處理指南》指南推薦靜脈 rt-PA 治療
1) 發病3小時內給予治療的入選患者應進行靜脈rt-PA治療(0.9mg/kg,最大劑量90mg) 。(I類推薦,A級證據)
原文:Intravenous rtPA(0.9mg/kg,maximun dose 90 mg) is recommended for selected patients who may be treated within 3 hours of onset of ischemic stroke (Class I; Level of Evidence A).
2) 適合靜脈rt-PA治療的患者,其治療獲益有時間依賴性,治療應儘快開始。到院至用藥時間(團注給藥時間)應在60分鐘內。(I類推薦,A級證據)
原文:In patients eligible for intravenous rtPA, benefit of therapy is time dependent, and treatment should be initiated as quickly as possible. The door-to-needle time (time of bolus administration) should be within 60 minutes from hospital arrival (Class I; Level of Evidence A). (New recommendation)
3) 建議給予能在卒中3-4.5小時之間用藥的適合患者以靜脈rt-PA治療(0.9mg/kg, 最大劑量90mg)。(I類推薦,B級證據)
原文:Intravenous rtPA (0.9mg/kg,maximun dose 90 mg) is recommended for administration to eligible patients who can be treated in the time period of 3 to 4.5 hours after stroke onset (Class I; Level of Evidence B).
