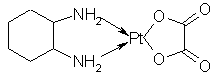成份
本品主要成份為奧沙利鉑。其化學名稱為:(1R-反式)-(1,-2環己二胺-N,N’)[草酸(2-)-O,O’]合鉑。
其結構式為:
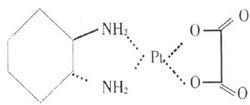 注射用奧沙利鉑
注射用奧沙利鉑分子式:CHNOPt
分子量:397.29
其輔料為乳糖。
性狀
本品為白色或類白色疏鬆塊狀物或無定形固體或粉末。
適應症
適用於經過氟尿嘧啶治療失敗後的結、直腸癌轉移的患者,可單獨或聯合氟尿嘧啶使用。
規格
(1)50mg (2)0.1g
用法用量
在單獨或聯合用藥時,推薦劑量為按體表面積一次130mg/m ,加入250~500ml 5%葡萄糖溶液中輸注2~6小時。沒有主要毒性出現時,每3周(21天)給藥1次。劑量的調整應以安全性,尤其是神經學的安全性為依據。
不良反應
1.血液學方面的不良反應主要是:貧血、白細胞減少、粒細胞減少及血小板減少。
2.非血液學方面的不良反應主要是:噁心、嘔吐、腹瀉。
3.神經系統:以末梢神經為主要表現,有時可伴有口腔周圍、上呼吸道和上消化道的痙攣及感覺障礙。
禁忌
1.對鉑類衍生物有過敏者禁用;
2.妊娠及哺乳期間慎用。
注意事項
1.奧沙利鉑應在具有抗癌化療經驗的醫師的監督下使用。特別是與具有潛在性神經毒性的藥物聯合用藥時,應嚴密監測奧沙利鉑神經學安全性。
2.應給予預防性或治療性的止吐用藥。
3.當出現血液毒性時(白細胞<2000/mm或血小板<50000/mm〉,應推遲下一周期用藥,直到恢復。
4.在每一療程之前應進行血液計數和分類,在每治療開始之前應進行神經學檢查,之後應定期進行。
5.患者在兩個療程之間持續存在疼痛性感覺異常或/和功能障礙時,本品用量應減少25%,調整劑量後若症狀仍存在或加重,應停藥。
6.不要與鹼性的藥物或介質、氯化合物、鹼性製劑等一起使用,也不要用含鋁的靜脈注射器具。
孕婦及哺乳期婦女用藥
未進行該項試驗且無可靠參考文獻。
兒童用藥
未進行該項試驗且無可靠參考文獻。
老年用藥
未進行該項試驗且無可靠參考文獻。
藥物相互作用
未進行該項試驗且無可靠參考文獻。
藥物過量
未進行該項試驗且無可靠參考文獻。
藥理毒理
本品屬於新的鉑類衍生物,其中央鉑原子被-草酸和1,2-二氨環已烷包圍,呈反式構象,是一個立體異構體。象其他鉑類衍生物一樣,奧沙利鉑通過產生烷化結合物作用於DNA,形成鏈內和鏈間交聯,從而抑制DNA的合成及複製。奧沙利鉑與DNA結合迅速,最多需15分鐘,而順鉑與DNA結合分為兩個時相,其中包括一個48小時後的延遲相。在人體內給藥一小時之後,通過測定白細胞內的加合物,可顯示其存在。複製過程中的DNA合成,其後NDA的分離、RNA及細胞蛋白質的合成均被抑制。某些對順鉑耐藥的細胞系,奧沙利鉑治療均有效。
藥代動力學
以130mg/m的劑量連續滴注2小時,其血漿總鉑達峰值5.1±0.8mg/ml/h,模擬的曲線下面積為189±45mg/ml/h。
當輸液結束時,50%的鉑與紅細胞結合,而另外50%存在於血漿中。25%的血漿鉑呈游離態,另外75%血漿鉑與蛋白質結合。蛋白質結合鉑逐步升高,於給藥第五天后穩定於95%的水平。藥物的清除分為兩個時相,其清除相半衰期約為40小時。多達50%的藥物在給藥48小時之內由尿排出(55%的藥物在6天之後清除)。由糞便排出的藥量有限(給藥11天后僅有5%經糞便排出)。
在腎功能衰竭的病人中,僅有可過濾性鉑的清除減少,而並不伴有毒性的增加,因此並不需要調整用藥劑量。
與紅細胞結合的鉑清除很慢。在給藥後的第22天,紅細胞結合鉑的水平為血漿峰值的50%,而此時大多數的總血漿鉑已被清除。在以後的用藥周期中,總的或不被離心的血漿鉑水平並無顯著升高;而紅細胞結合鉑出現明顯的早期累積現象。
貯藏
密閉,在25℃以下保存。
包裝
西林瓶,1/瓶/盒。
有效期
(1) 50mg 24個月 (2)0.1g 暫定24個月。
執行標準
(1) 50mg YBH04792011
(2) 0.1g YBH08102004