物理性質
氫氧化銨,屬於鹼。氨溶於水大部分形成氫氧化銨,是氨水的主要成分(氨水是混合物)。易揮發逸出氨。有強烈的刺激性氣味。能與乙醇混溶。呈鹼性。中等毒,半數致死量(大鼠,經口)350㎎/㎏。有腐蝕性。催淚性。氨水中含有離子NH₄⁺、NH₂⁻、OH⁻和H₃O⁺。氨溶於水得到氫氧化銨此反應的Kb=1.8×10-5。1M氨水的pH值為11.63,大約有0.42%的NH₃變為NH₄+。
氫氧化銨是弱電解質,在水中可以部分電離成銨根離子和氫氧根離子(因此有時也稱為氫氧化銨),顯弱鹼性:NH₃·H₂O====(NH₄⁺)+(OH⁻)
氨水與氫氧化銨是有區別的,氫氧化銨是氨水中的溶質之一。
化學性質
氫氧化銨有一定的腐蝕作用。對銅的腐蝕比較強,鋼鐵比較差,對水泥腐蝕不大。對木材也有一定腐蝕作用。氨水中僅有一小部分氨分子與水反應而成銨根離子NH4+和氫氧根離子OH-,呈弱鹼性。氨水能與酸反應,生成銨鹽。濃氨水揮發出的氨氣與揮發性酸(如濃鹽酸和濃硝酸)揮發出的酸霧相遇會產生白煙。氫氧化銨不穩定,易分解而生成氨和水。由於氨水具有揮發性,故氨水應密封保存在棕色或深色試劑瓶並配橡皮塞中,放在冷暗處。氨水顯鹼性,是很好的沉澱劑,它能與多種金屬離子反應,生成難溶性弱鹼或兩性氫氧化物。氨也表現出弱的還原性,可被強氧化劑氧化。如氫氧化銨可與氯水發生反應:
氫氧化銨即NH4OH,氯水中有HCl和HClO(是Cl2與水反應生成),所以NH4OH先與氯水中的HCl反應生成NH4Cl和H2O,之後與HClO反應,生成NH4ClO和H2O.
反應方程式為:
NH4OH+HCl=NH4Cl+H2O
NH4OH+HClO=NH4ClO+H2O
製備方法
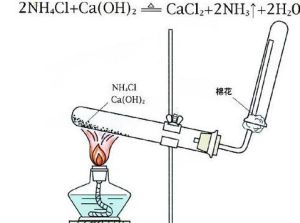 實驗室制氨氣
實驗室制氨氣工業合成氨通過N2+3H2=高溫、高壓和催化劑=2NH3(可逆反應)氨氣溶於水則得到氨水,氨水為氫氧化銨的水溶液。

