有機元素定性分析
正文
有機分析的一個分支學科,指有機化合物中碳、氫、氧、氮、硫、鹵素、磷、矽、硼和有關金屬元素的定性分析,不僅能提供關於有機物的組成和鑑定方法的信息,而且在結構分析中對質譜法、紅外光譜、紫外光譜和核磁共振譜圖的解釋是不可缺少的。定性分析通常分兩步進行:先使有機物分子破壞,變成無機離子;然後用適當的試劑或儀器分析方法檢驗生成的無機離子。通常破壞有機物都是套用較強的試劑,因此對於試樣的本性要有初步了解,例如有無爆炸性或劇毒,以便採取適當的防護措施。試樣的分解 鈉熔法 把有機化合物加到灼熱的金屬鈉中就起猛烈的反應,其中的碳、氫、氧、氮、硫、鹵素生成碳、一氧化碳、二氧化碳、氰化鈉、硫化鈉和鹵化鈉。當金屬鈉不足時,氮和硫生成硫氰化鈉。但金屬鈉過量時,硫氰化鈉又分解為氰化鈉和硫化鈉:
NaCNS+2Na─→NaCN+Na2S
使用過多的金屬鈉將使萃取液的鹼性太強,應該避免。熔化物用水萃取後,檢驗萃取液中的陰離子。如果用金屬鉀代替金屬鈉則效果更好。鈉熔法的缺點是氮往往會漏檢,特別是低沸點的胺、胺鹽和醯胺以及有爆炸性的化合物(例如重氮鹽和多硝基物等)。改進的方法是預先在試樣中加入少量的萘或蔗糖;或改用其他的活性金屬代替鈉。再如,對於沸點很低的試樣使用鈉熔法往往也有困難。用鎂和碳酸鉀的混合物作熔劑,可克服這些缺點。
鋅-碳酸鈉熔化法 此法中含硫物生成的硫化鋅不溶於水,因此需要在濾渣中檢驗硫:
ZnS+2H+─→Zn2++H2S
H2S+Pb2+─→PbS↓+2H+
碳酸鋰在熱水中的溶解度比碳酸鉀或碳酸鈉小,用水萃取後可以濾去,以免以後酸化萃取液時產生大量的二氧化碳氣,將氰化氫、硫化氫、鹵化氫帶走。因此,用碳酸鋰代替碳酸鉀或碳酸鈉可以進行微量分析。氧瓶法 將有機化合物在氧氣中燃燒,使所含的元素變成相應的氧化物,用加有幾滴30%過氧化氫的2%氫氧化鈉溶液吸收(分析金屬元素有時改用2%鹽酸或2%硝酸作吸收液)。然後檢驗吸收液中的離子。這種方法的優點是試樣用量小、分解完全和操作簡單,可以在錐形燒瓶或分液漏斗中進行,但需要配一個特製的磨口塞子,在塞子下面熔接一段鉑絲(有時也可用鎳絡絲代替)。把試樣(難分解的試樣,例如某些有機氟或矽化合物應該混入少量的過氧化鈉)用一小塊濾紙包好後,系在鉑絲上。在氧瓶中裝好吸收液和充滿氧氣(有時不充氧氣就在空氣中進行也可)後,用火點著濾紙,放進瓶中,迅速塞緊塞子,燃燒完畢後放冷,搖勻。
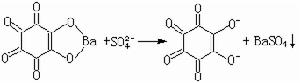
元素的鑑定 用鈉熔法和鋅-碳酸鈉熔化法分解的試樣 其中的元素可用以下方法鑑定:①硫可用亞硝基鐵氰化鈉法(式1)、乙酸鉛法(式2)、疊氮鈉法(式3):
S2-+【Fe(CN)5NO】2-─→【Fe(CN)5NOS】4- (1)
S2-+Pb2+─→PbS (2)
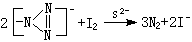 (3)
(3)
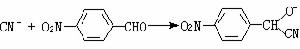 (4)
(4) 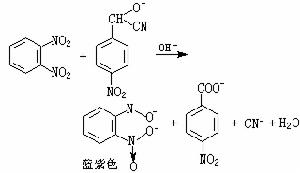
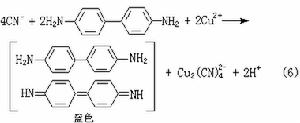
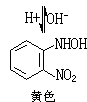 (5)
(5) 
3CNS-+Fe3+─→Fe(CNS)3 (7)
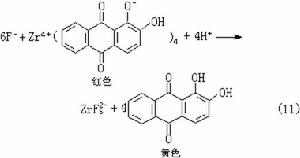
④ 氯可用鹵化銀法(式8),溴可用氧化法(式9),碘用亞硝酸氧化法(式10),氟用茜素-氯化鋯法(式11):Cl-+Ag+─→ AgCl (8)
2Br-+Cl2─→ Br2+2Cl- (9)
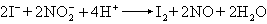 (10)
(10) 
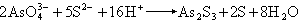 (12)
(12)
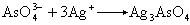 (13)
(13)
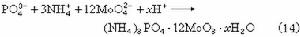
(NH4)3PO4·12MoO3·xH2O+2H2N
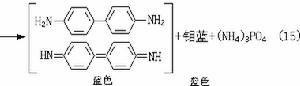
⑦ 矽用矽鉬藍法(式16和17):
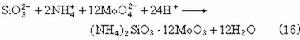
(NH4)2SiO3·12MoO3+2H2N
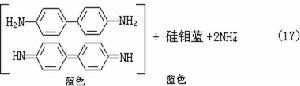 ⑧ 硼可用薑黃法(式18):
⑧ 硼可用薑黃法(式18): 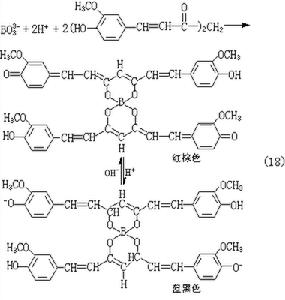
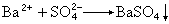 (19)
(19)  (20)
(20)
紅棕色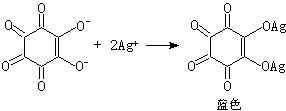 (21)
(21)
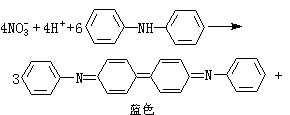
4NO+8H2O (22)
氧的分析 有機化合物中的氧一般不直接分析,也沒有簡單的分析方法。如有必要可將試樣在氮氣流中灼燒到950~1000°C,使分解物通過1100~1150°C的炭粒,氧變為一氧化碳氣,然後在120°C與五氧化二碘反應:C+O─→CO
5CO+I2O5─→5CO2+I2
鈉珠法分析氮與硫 試樣與新制的鈉珠和甲苯放在一起加熱,氮變成氨,硫變成硫化鈉。前者可用石蕊試紙檢驗,後者酸化後用乙酸鉛試紙檢驗。拜耳斯坦法檢驗氯、溴、碘 含氯、溴、碘的有機物與氧化銅在煤氣燈的氧化焰中一起灼燒,可以產生綠色的火焰。由於氟化銅不能揮發,不能使焰色變綠。此法非常靈敏,但不可靠,原因為:①鹵素作為雜質存在,也能使燈焰顯綠色;②揮發性很強的試樣在氧化銅沒有灼熱前已揮發殆盡,因而漏檢;③許多不含鹵素的化合物,例如脲、硫脲、吡啶、喹啉或某些羧酸,由於能產生揮發性的銅鹽,也使焰色變綠。
硝酸銀試紙檢磷法 膦化合物在鈉熔法中有磷化氫氣生成,可使硝酸銀試紙變黑。這是分析膦化合物的簡便方法,但是膦酸酯類必須預先在試樣中加入蔗糖,然後進行鈉熔法。
汞的分析 有機汞化合物在鈉熔法中往往容易揮發,可與無水碳酸鈉混勻後加熱,生成的汞蒸氣可使白色的碘化亞銅迅速變成猩紅色或桃紅色:
Hg+CuI─→HGI+Cu
本法十分靈敏,但如有氨氣或硫化氫氣產生時有干擾;前者可用焦硫酸鉀消除,後者則用氧化鉛去除。其他的金屬元素 把試樣灼燒成灰分後,進行化學分析或儀器分析。
