釋義
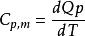 摩爾定壓熱容
摩爾定壓熱容公式表示為:
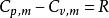 摩爾定壓熱容
摩爾定壓熱容 摩爾定壓熱容
摩爾定壓熱容對於理想氣體,有: ,其中, 為氣體的摩爾定容熱容,R為摩爾氣體常數。
摩爾定壓熱容與溫度函式的關係,通常可以表示成如下的經驗公式:
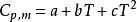 摩爾定壓熱容
摩爾定壓熱容;
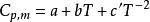 摩爾定壓熱容
摩爾定壓熱容;
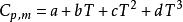 摩爾定壓熱容
摩爾定壓熱容;
式中a,b,c,c',d均為係數,具有不同的單位。使用這些公式時要注意所適用的溫度範圍。(詳見《物理化學上冊》附表)
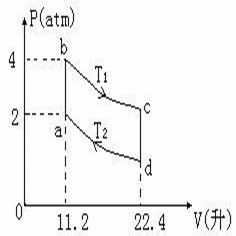
套用——單純pVT變化過程H的計算
由C的定義可知,利用C可計算物質的量為n的系統發生恆壓的單純pVT變化過程的Q及該過程中系統的△H (式子1):
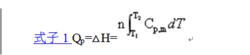 摩爾定壓熱容
摩爾定壓熱容若系統發生不恆壓的單純pVT變化過程.該過程中系統△H的計算也要用到C,現分理想氣體、凝聚態物質(液體、固體)兩種情況予以討論。
①理想氣體 由焓的定義及理想氣體狀態方程有H=U+pV=U+nRT
因理想氣體的熱力學能U僅僅是T的函式,故理想氣體的H=U+nRT也僅僅是T的函式,可寫作式子2:
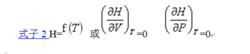 摩爾定壓熱容
摩爾定壓熱容基於此結論,則可得出計算理想氣體單純pVT變化時的△H的通式,即式子3 :
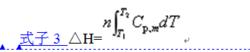 摩爾定壓熱容
摩爾定壓熱容所謂通式,是指理想氣體發生單純PVT變化時,不論過程恆壓與否,均可用來計算理想氣體單純PVT變化過程的焓變△H。
但應注意的是,若過程不恆壓,則過程的熱與過程中系統的焓變不等,即Q≠△H。
②凝聚態物質
所謂凝聚態物質,是指處於液態或固態的物質,如液態水、固態金屬銅等。對這類物質,在T一定時,只要壓力變化不大,壓力P對△H的影響往往可忽略不計,故凝聚態物質發生單純pVT變化時系統的焓變,僅取決於始、末態的溫度,即有式子4:
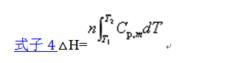 摩爾定壓熱容
摩爾定壓熱容至於過程的△U,因△H=△U+△(pV).而對凝聚態系統△(pV)≈0,故有式子5:
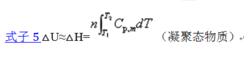 摩爾定壓熱容
摩爾定壓熱容 摩爾定壓熱容
摩爾定壓熱容需要注意的是,儘管凝聚態物質變溫過程中系統體積變化很小,也不能認為是恆容過程 。