英文對照
molarabsorptivity;molarabsorptioncoefficient;molarabsorptionabsorptivity;
學術解釋
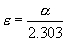 摩爾光吸收
摩爾光吸收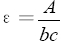 摩爾光吸收
摩爾光吸收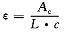 摩爾光吸收
摩爾光吸收 摩爾光吸收
摩爾光吸收T=I/I0=e-kb
其中I0為入射光強,I為透射光強,e為自然對數的底,k為常數,b為光程長度(通常以cm表示)。
比爾定律等同於Bouguer定律,只是比爾定律以濃度來表達。將兩個定律結合起來,組成Beer-Bouguer定律:
T=I/I0=e-kbc
其中c為吸光物質的濃度(通常以g/L或mg/L為單位)。將上式取以10為底的對數後,得到線性表達式:
A=-logT=-log(I/I0)=log(I0/I)=εbc
其中A為吸光度,ε是摩爾吸收光係數或消光係數。
上述表達式通常稱為比爾定律。它表明,當特定波長的單色光通過溶液時,樣品的吸光度與溶液中吸收物濃度和光通過的距離成正比。
在波長、溶液和溫度確定的情況下,摩爾消光係數是由給定物質的特性決定的。實際上,測得的摩爾消光係數也和使用的儀器有關。因此,在定量分析中,通常並不用已知物質的摩爾消光係數,而是用一個或多個已知濃度的待測物質作一條校準或工作曲線。
===================================
:①吸光係數:Beer定律的數學表達式為A=kbc,若溶液的濃度c以g/L為單位,b為光徑以cm為單位,則常數K稱為吸光係數,以a表示,其單位為升/(克·厘米)[L/(g·cm],A=kbc可寫成A=abc。②摩爾吸光係數:公式A=kbc中的以為1mol/L,b為1cm時,則係數k稱為摩爾吸光係數,以ε表示,單位為升/(摩爾·厘米)[L/(mol·cm)],A=kbc可寫成A=εc。在實際工作中,不能直接用1mol/L這種高濃度的溶液測定吸光度,而是在稀釋成適當濃度時測定吸光度進行運算。ε值與入射光波長、溶液的性質等因素有關。如NADH在260nm時ε為15000,寫成ε260NADH=15×103;在340nm時ε為6220,寫成ε340NADH=6.22×103。③比吸光係數:如公式A=kbc中的c是百分濃度(w/v)b為cm,則常數k可用E%表示,稱為比吸光係數或百分吸光係數,A=kbc可寫成A=E%bc。當待測物的化學結構是已知者可用ε值分析,若所測物的化學結構是未知的,則ε無法確定,此時用比吸光係數分析就很方便。a、ε和E常用作粗定量分析,主要用於定性分析。
