定義
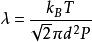 平均自由程
平均自由程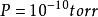 平均自由程
平均自由程對於氣體分子:相鄰兩次碰撞之間的平均距離,即稱為分子的平均自由程。若分子有效直徑為d,氣體壓強為P,則平均自由程為;對於室溫下的空氣分子,λ[cm] = 5×10^-3/P[Torr],當時,λ將達到500km。
對於半導體中的載流子:相鄰兩次碰撞之間的平均距離,即稱為載流子的平均自由程;其典型的數值為10nm,這比晶格常數要大得多。而在相鄰兩次碰撞之間的平均時間,即稱為載流子的 平均自由時 間(Mean free time),其值t決定於平均自由程λ和熱運動速度v,即有t= λ/v;典型的數值為1ps,即10^(-12)s。
在氣體分子的碰撞理論的剛球模型中,認為分子只在碰撞的一剎那發生相互作用,而在其他時間內,分子作直線運動。相繼兩次碰撞間所走的路程叫分子的自由程。由於氣體分子的數目很大,碰撞頻繁,運動的變化劇烈,故其自由程只有統計意義。這個概念對研究氣體的特性(如擴散)和電子或中子之類的粒子穿過固體的運動很重要。
 平均自由程
平均自由程關係式
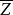 平均自由程
平均自由程一個分子在單位時間內與其他分子的碰撞的平均次數,為分子的平均碰撞頻率 ,用表示
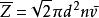 平均自由程
平均自由程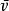 平均自由程
平均自由程 平均自由程
平均自由程其中為平均速度,為分子數密度,那么平均自由程:
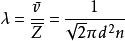 平均自由程
平均自由程因 p=nkT(在一定條件下)
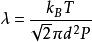 平均自由程
平均自由程所以: