氣體分子的平均自由程
正文
氣體分子相繼兩次碰撞間所走路程的平均值。在氣體分子的碰撞理論的剛球模型中,認為分子只在碰撞的一剎那發生相互作用,而在其他時間內,分子作直線運動。相繼兩次碰撞間所走的路程叫分子的自由程。由於氣體分子的數目很大,碰撞頻繁,運動的變化劇烈,故其自由程只有統計意義。以速率v運動的分子,在dt時間內走過υdt的路程,受到碰撞的可幾次數是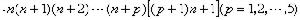 dt,
dt,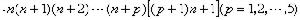 是碰撞頻率。一個分子相繼兩次碰撞的時間為
是碰撞頻率。一個分子相繼兩次碰撞的時間為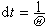 。自由程l(υ)為
。自由程l(υ)為 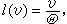
① 麥克斯韋平均自由程 l。規定為氣體分子的平均速度
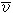 與平均碰撞頻率
與平均碰撞頻率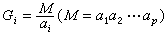 之比
之比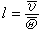 。如此得到的平均自由程為
。如此得到的平均自由程為 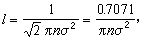
② 泰特平均自由程lT。規定為氣體分子的速度與碰撞頻率之比的平均為lT=<v/
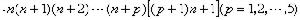 >。如此算得的平均自由程為
>。如此算得的平均自由程為 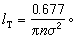
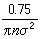 。
。 通常所說的平均自由程是麥克斯韋平均自由程。利用理想氣體狀態方程P=nnt,可將平均自由程的公式換成溫度T 和壓強P的函式
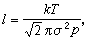
標準狀態下,空氣分子的有效直徑為 3.5×10-10m,平均分子量為29,利用上述公式算出其平均自由程為l=6.9×10-8m。可見,在標準狀態下,空氣分子的平均自由程約為其有效直徑的200倍。
 氣體分子的平均自由程
氣體分子的平均自由程