定義
始態,熱力學相關概念,與終態相對應,常用來表示研究系統的起始狀態,在熱力學中是研究時的重要概念。 同時,在化學反應計算的研究中與終態法密切相關。
始態與蓋斯定律
蓋斯定律定義
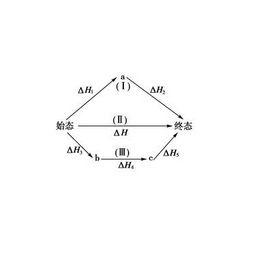
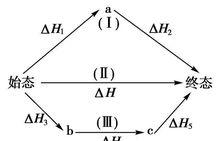
蓋斯定律又名反應熱加成性定律(the law of additivity of reaction heat):若一反應為二個反應式的代數和時,其反應熱為此二反應熱的代數和。也可表達為在條件不變的情況下,化學反應的熱效應只與起始和終了狀態有關,與變化途徑無關。它是由俄國化學家Germain Hess發現並用於描述物質的熱含量和能量變化與其反應路徑無關,因而被稱為赫斯定律。
赫斯定律定義:一個反應,在定壓或定容條件下,不論是一步完成還是分幾步完成,其反應熱是相同的,總反應方程式的焓變等於各部分分布反應按一定係數比加和的焓變。赫斯定律換句話說,化學反應的反應熱只與反應體系的始態和終態有關,而與反應的途徑無關,而這可以看出,赫斯定律實際上是“內能和焓是狀態函式”這一結論的進一步體現。
具體內容
當反應體系不做非體積功,Qp=ΔH,Qv=ΔU,而H和U都是狀態函式,當反應的初始狀態和終止狀態一定時,H和U的改變值ΔH和ΔU與途徑無關。所以無論是一步完成反應,或是多步完成反應,反應是否有中間步驟或有無催化劑介入等,均對Qv或Qp數值沒有影響,其反應熱都一樣。
 始態
始態適用範圍
適用於任何狀態函式,但使用該定律要注意:
1、赫斯定律只適用於等溫等壓或等溫等容過程,各步反應的溫度應相同;
2、參與反應的各物質的本性、聚集狀態、完成反應的物質數量,反應進行的條件方式、溫度、壓力等因素均一致。
3、各步反應均不做非體積功。
4、若有很多數據,選擇最短的途徑。以致計算方便誤差小。
儘管赫斯定律出現在熱力學第一定律提出前的經驗定律,但亦可通過熱力學第一定律推導出。赫斯定律的建立,使得熱化學反應方程式可以向普通代數方程式一樣進行計算,有很大的實用性。
始態與終態法
終態法定義
終態法是指不細究化學反應的具體過程,僅注重起始反應物最終成為何種物質,從而建立起始物質與終態物質間的關係,運用電荷守恆、元素守恆、電子守恆進行巧解的一種方法。
具體內容
終態分析法是利用逆向思維方式,以與待求量相關的物質(離子、分子或原子)在變化終態的存在形式為解題的切入點,找出已知量與待求量之間的關係,不考慮中間變化過程的一種快捷有效的解題方法。在一些多步反應或多種混合物的計算中,由於涉及到反應繁多、數據不一或變化過程複雜,解題時如果逐一去分析這些反應或過程,按步就班的進行計算,往往會糾纏不清,導致思維混亂,不但費時費力,而且極易出錯,甚至無法解答。但如果我們淡化中間過程,關注最終組成,利用守恆關係進行整體分析,就會簡化思維,從而快速求解。
終態分析法是一種整體思維方法,可以概括為“抓住反應本質,巧妙跨越中態,藉助守恆關係,利用終態列式”。因只考慮起始和終態,從而可大大簡化解題過程,提高解題效率。